题目内容
19.下列关于有机物X(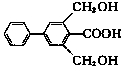 )的说法正确的是.
)的说法正确的是.| A. | 分子式为C15H19O4 | |
| B. | 苯环上的一氯代物有7种 | |
| C. | 能发生氧化反应和取代反应 | |
| D. | 1molX与足量的NaOH溶液反应,最多消耗3molNaOH |
分析 由结构可知分子式,分子中含-OH、-COOH,苯环上含4种H,结合醇、羧酸的性质来解答.
解答 解:A.由结构可知,分子式为C15H14O4,故A错误;
B.苯环上含4种H,苯环上的一氯代物有4种,故B错误;
C.含-OH可发生取代、氧化反应,含-COOH可发生取代反应,故C正确;
D.只有-COOH与NaOH反应,则1molX与足量的NaOH溶液反应,最多消耗1molNaOH,故D错误;
故选C
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意醇、羧酸的性质,题目难度不大.

练习册系列答案
相关题目
7.在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g)?C(g)+D(g),5min后达到平衡,测得K=1.若在温度不变的情况下将容器的体积扩大为原来的1倍,测得A的转化率不发生变化,下列说法正确的是( )
| A. | 改变条件前后,B的转化率均为40% | |
| B. | 改变条件前后,C的反应速率保持不变 | |
| C. | 若保持温度和体积不变,在容器中再充入1molA和1molB,B的转化率不变 | |
| D. | 若保持温度和体积不变,在容器中再充入0.5molB、1molC和1molD,B的转化率增大 |
10.常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)常温下,等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,试分析原因:NO2-水解显碱性,对铵根离子水解起到促进作用.0.1mol•L-1NH4NO2溶液中离子浓度由大到小的顺序是c(NO2-)>c(NH4+)>c(H+)>c(OH-),NO2-水解反应的平衡常数Kh=1.4×10-11 mol•L-1(保留两位有效数字).
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH>7 (填“>”、“<”或“=”);反应NH3•H2O+H2CO3?NH4++HCO3-+H2O的平衡常数K=800.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O═HCO3-+HClO:
| NH3•H2O | 2×10-5 |
| HNO2 | 7×10-4 |
| HClO | 3×10-8 |
| H2CO3 | K1=4×10-7 K2=4×10-11 |
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH>7 (填“>”、“<”或“=”);反应NH3•H2O+H2CO3?NH4++HCO3-+H2O的平衡常数K=800.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O═HCO3-+HClO:
7.地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题.用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一.
(1)Fe还原水体中NO3-的反应原理如图1所示.
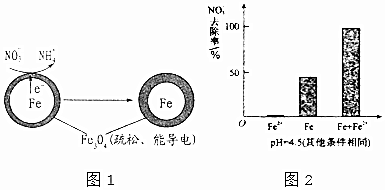
作负极的物质是铁;正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如表:
在pH=4.5的水体中,NO3-的去除率低的原因是FeO(OH)不导电,阻碍电子转移.
(3)为提高pH=4.5的水体中NO3-的去除率,某课题组在初始pH=4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图2:①此实验可得出的结论是本实验条件下,Fe2+不能直接还原NO3-,在Fe和Fe2+共同作用下能提高NO3-的去除率,Fe2+的作用可能是Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4.表中NO3-去除率和铁的最终物质形态不同的原因初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池.(写出一条)
(1)Fe还原水体中NO3-的反应原理如图1所示.

作负极的物质是铁;正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 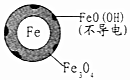 | 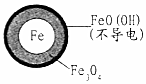 |
(3)为提高pH=4.5的水体中NO3-的去除率,某课题组在初始pH=4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图2:①此实验可得出的结论是本实验条件下,Fe2+不能直接还原NO3-,在Fe和Fe2+共同作用下能提高NO3-的去除率,Fe2+的作用可能是Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4.表中NO3-去除率和铁的最终物质形态不同的原因初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池.(写出一条)
14.下列图示的实验操作,能实现相应实验目的是( )
| A. |  蒸干CuCl2饱和溶液制备无水CuCl2 | |
| B. | 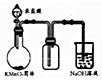 实验室制取并收集少量纯净氯气 | |
| C. | 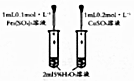 研究催化剂对H2O2分解速率的影响 | |
| D. | 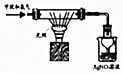 验证甲烷和氧气光照条件下发生取代反应 |
4.短周期主族元素X、Y、Z、W的原子序数依次增大,X元素形成的一种单质是自然界中硬度最大的物质,Y位于周期表中VA族,Z是短周期中金属性最强的元素,W3-与氩原子核外电子排布相同.下列说法正确的是( )
| A. | 原子半径:r(Z)>r(W)>r(Y)>r(X) | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Z3W中既含有离子键又含有共价键 | |
| D. | X的单质不能与Y的最高价氧化物对应的水化物反应 |
11.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中,溶液变浑浊 | 酸性:碳酸>苯酚 |
| B | 向1mL 0.1mol•L-1 MgSO4溶液中,滴入2滴0.1mol•L-1 NaOH溶液,产生白色沉淀,再滴入2滴0.1mol•L-1CuSO4溶液,白色沉淀逐渐变为蓝色 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| C | 向蛋白质溶液中加入甲醛溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
| D | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
8.设NA为阿伏加德罗常教,下列叔述正确的是( )
| A. | 常温常压下,9.2gNO2气体中.分子数为0.2NA | |
| B. | pH=2的硫酸溶液中,H+数目为0.01NA | |
| C. | 将0.05molFeCl3全部转化为Fe(OH)3胶体,则胶粒数目为0.05NA | |
| D. | 20gD2O中含有的质子数为10NA |
9.根据下列实验操作与现象所得到的结论正确的是( )
| 选项 | 实验操作与现象 | 结论 |
| A | 向蛋白质溶液中滴加Pb(NO3)2溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| B | 测定浓度为 0.1mol•L-1CH3COONa与HCOONa 溶液的pH,CH3COONa溶液的pH较大 | 酸性:CH3COOH>HCOOH |
| C | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量0.l mol•L-1AgNO3溶液,出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |