题目内容
5.Fe和Mg与H2SO4反应的实验如下:实验 |  |  |  |  |
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
| A. | I中产生气体的原因是:Fe+2H+═Fe2++H2↑ | |
| B. | 取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体 | |
| C. | Ⅲ中现象说明Mg在浓H2SO4中没被钝化 | |
| D. | Ⅳ中现象说明Mg的金属性比Fe强 |
分析 A.稀硫酸具有弱氧化性,与Fe反应生成氢气;
B.浓硫酸具有强氧化性,发生钝化;
C.Mg与浓硫酸可发生氧化还原反应生成二氧化硫气体;
D.构成原电池,Mg为负极失去电子,Fe为正极,正极上氢离子得到电子.
解答 解:A.稀硫酸具有弱氧化性,与Fe反应生成氢气,发生的离子反应为Fe+2H+═Fe2++H2↑,故A正确;
B.浓硫酸具有强氧化性,发生钝化,生成致密的氧化膜覆盖在Fe的表面,不能与CuSO4溶液发生置换反应生成Cu,故B错误;
C.Mg与浓硫酸可发生氧化还原反应生成二氧化硫气体,则Ⅲ中现象说明Mg在浓H2SO4中没被钝化,故C正确;
D.构成原电池,Mg为负极失去电子,Fe为正极,正极上氢离子得到电子,可知Mg的金属性比Fe强,故D正确;
故选B.
点评 本题考查金属的化学性质,为高频考点,把握发生的反应及现象的关系为解答的关键,注意钝化、原电池等为解答的难点,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.A3+微粒核外有46个电子,质量数为115,则A原子核里的中子数是( )
| A. | 46 | B. | 66 | C. | 115 | D. | 49 |
12.某温度下,水的离子积Kw=1×10-13,则该温度下,pH=12的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=10,则强碱与强酸的体积比是( )
| A. | 11:1 | B. | 9:1 | C. | 1:11 | D. | 1:9 |
20.现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示);
(2)D是AgNO3溶液,E是Al2(SO4)3溶液(均写化学式).
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示);
(2)D是AgNO3溶液,E是Al2(SO4)3溶液(均写化学式).
10.下列物质在常温下发生水解时,对应的水解方程式正确的是( )
| A. | Na2CO3:CO32-+H2O?2OH-+CO2↑ | B. | NH4NO3:NH4++H2O?NH3•H2O+H+ | ||
| C. | CuSO4:Cu2++2H2O?Cu(OH)2↓+2H+ | D. | KF:F-+H2O═HF+OH- |
17.将①H+、②NH4+、③NO3-、④K+、⑤CO32-、⑥OH-分别加入H2O中,基本上不影响水的电离平衡的是( )
| A. | ③④ | B. | ②③⑥ | C. | ①⑥ | D. | ②④ |
15.下列关于氯气及氯水的说法不正确的是( )
| A. | 氯水加入有色布条后,有色布条褪色,说明氯水中有HClO分子存在 | |
| B. | 制取漂白液的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O,该反应的氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 1mol Cl2与足量Fe反应,转移的电子的物质的量为3 mol | |
| D. | 向某铁盐溶液中滴入KSCN溶液,无明显现象,加入氯水,溶液显血红色,说明原溶液中含有Fe2+ |
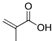 ,E的化学式为C9H10O2
,E的化学式为C9H10O2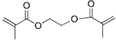
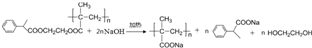 .
.