题目内容
10.下列物质在常温下发生水解时,对应的水解方程式正确的是( )| A. | Na2CO3:CO32-+H2O?2OH-+CO2↑ | B. | NH4NO3:NH4++H2O?NH3•H2O+H+ | ||
| C. | CuSO4:Cu2++2H2O?Cu(OH)2↓+2H+ | D. | KF:F-+H2O═HF+OH- |
分析 A.碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
B.铵根离子水解生成一水合氨和氢离子;
C.铁离子水解生成氢氧化铜和氢离子,不会生成氢氧化铜沉淀;
D.氟离子水解生成氟化氢和氢氧根离子,水解反应为可逆反应.
解答 解:A.碳酸钠溶液中,碳酸根离子水解分步进行,主要以第一步为主,碳酸根离子水解的方程式为:CO32-+H2O?HCO3-+OH-,故A错误;
B.铵根离子水解的离子方程式为:NH4++H2O?NH3•H2O+H+,故B正确;
C.铜离子水解生成的不是氢氧化铜沉淀,铜离子水解方程式为:Cu2++2H2O?Cu(OH)2+2H+,故C错误;
D.水解反应为可逆反应,应该用可逆号,氟离子水解的方程式为:F-+H2O?HF+OH-,故D错误;
故选B.
点评 本题考查了水解的离子方程式的正误判断,题目难度中等,注意明确盐的水解原理,明确水解反应为可逆反应,多元弱酸根离子的水解分步进行,主要以第一步为主.

练习册系列答案
相关题目
16.下列有关二氧化硅的叙述中不正确的是( )
| A. | HF能用于刻蚀玻璃,制作玻璃量筒刻度 | |
| B. | SiO2是制光导纤维的主要原料 | |
| C. | 硅酸可由SiO2直接制得 | |
| D. | SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应 |
1.下列叙述正确的是( )
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH | |
| D. | 电解精炼铜时,杂质银变成银离子进入溶液中 |
18.在一接近中性的含Na+的澄清溶液中,可能还含NH4+;Fe2+;I-;Br-;CO32-;SO32-六种离子中的几种.①在原溶液中,滴加足量氯水后,有气泡产生;溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝色.根据上述实验事实推断,该溶液中肯定不存在的离子是( )
| A. | NH4+、Br-、CO32- | B. | Fe2+、I-、SO32- | C. | NH4+、Br-;、SO32- | D. | Fe2+、I-、CO32- |
5.Fe和Mg与H2SO4反应的实验如下:
关于上述实验说法不合理的是( )
实验 | 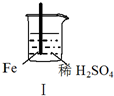 | 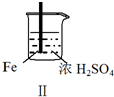 | 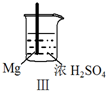 | 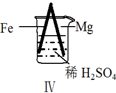 |
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
| A. | I中产生气体的原因是:Fe+2H+═Fe2++H2↑ | |
| B. | 取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体 | |
| C. | Ⅲ中现象说明Mg在浓H2SO4中没被钝化 | |
| D. | Ⅳ中现象说明Mg的金属性比Fe强 |
15.量取25.00mL硫酸溶液,可选用的仪器是( )
| A. | 50mL量筒 | B. | 25mL量筒 | C. | 50mL碱式滴定管 | D. | 50mL酸式滴定管 |
20.下列有关化学用语表示正确的是( )
| A. | 26Fe的原子结构示意图: | B. | 氮化硅的化学式:Si3N4 | ||
| C. | 基态氮原子的电子排布图: | D. | 29Cu的电子排布式:[Ar]3d94s2 |



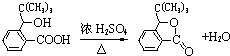 (写明反应条件).
(写明反应条件).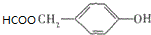 .
. 的路线流程图(其它试剂任选).(合成路线流程图表达方法例如下
的路线流程图(其它试剂任选).(合成路线流程图表达方法例如下 :)
:)