题目内容
17.将①H+、②NH4+、③NO3-、④K+、⑤CO32-、⑥OH-分别加入H2O中,基本上不影响水的电离平衡的是( )| A. | ③④ | B. | ②③⑥ | C. | ①⑥ | D. | ②④ |
分析 H+、OH-抑制水电离,盐溶液中的弱酸阴离子发生水解反应而促进水电离,溶液中强酸阴离子和强碱阳离子不影响水的电离平衡,据此分析解答.
解答 解:①H+、⑥OH-抑制水电离,弱离子发生水解反应而促进水电离,②⑤属于弱离子,能发生水解反应而促进水电离,则不影响水电离的离子有③NO3-、④K+,故选A.
点评 本题以盐类水解为载体考查水的电离,明确哪些微粒促进水电离、哪些微粒抑制水电离即可解答,知道其促进或抑制原理,题目难度不大.

练习册系列答案
相关题目
3.两种气态烃组成的混合气体0.1mol,完全燃烧得0.15mol CO2和3.6g H2O,下列关于该混合气体的说法正确的是( )
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有乙烷 | D. | 一定有甲烷 |
8.以下物质检验的结论可靠的是( )
| A. | 往溶液中加入浓溴水,出现白色沉淀,说明含有苯酚 | |
| B. | 向含酚酞的氢氧化钠溶液中加入溴乙烷,加热后红色变浅,说明溴乙烷发生了水解 | |
| C. | 在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明还有乙酸剩余 | |
| D. | 将乙醇和浓硫酸共热后得到的气体通入溴水中,溴水褪色,说明生成了乙烯 |
5.Fe和Mg与H2SO4反应的实验如下:
关于上述实验说法不合理的是( )
实验 | 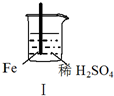 | 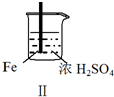 | 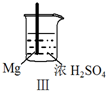 | 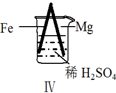 |
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
| A. | I中产生气体的原因是:Fe+2H+═Fe2++H2↑ | |
| B. | 取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体 | |
| C. | Ⅲ中现象说明Mg在浓H2SO4中没被钝化 | |
| D. | Ⅳ中现象说明Mg的金属性比Fe强 |
12.已知反应:①101kPa时,2C(s)+O 2(g)═2CO(g)△H=-221kJ•mol-1②稀溶液中,
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列结论正确的是( )
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | ①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应的成1 mol水,放出57.3 kJ热量 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
9.硅被誉为无机非金属材料的主角.下列物品用到硅单质的是( )
| A. | 玻璃制品 | B. | 石英钟表 | C. | 计算机芯片 | D. | 光导纤维 |
7.下列离子方程式书写正确的是( )
| A. | 钠与水的反应 Na+H2O═OH-+H2↑ | |
| B. | NaHCO3溶液与盐酸的反应 CO32-+2H+═H2O+CO2↑ | |
| C. | 用FeCl3溶液腐蚀铜线路板 Cu+Fe3+═Cu2++Fe2+ | |
| D. | AlCl3溶液中加入过量氢氧化钠溶液 Al3++4OH-═AlO2-+2H2O |
