题目内容
15.下列关于氯气及氯水的说法不正确的是( )| A. | 氯水加入有色布条后,有色布条褪色,说明氯水中有HClO分子存在 | |
| B. | 制取漂白液的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O,该反应的氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 1mol Cl2与足量Fe反应,转移的电子的物质的量为3 mol | |
| D. | 向某铁盐溶液中滴入KSCN溶液,无明显现象,加入氯水,溶液显血红色,说明原溶液中含有Fe2+ |
分析 氯气通入溶液中,与水反应发生反应:Cl2+H2O═HCl+HClO,则氯水中存在:Cl2、H2O、HClO、H+、Cl-、ClO-、OH-,
A.HClO具有漂白性;
B.反应中氯气既是氧化剂也是还原剂;
C.1mol Cl2得到2mol电子;
D.亚铁离子与KSCN溶液不反应,可被氯气氧化.
解答 解:氯气通入溶液中,与水反应发生反应:Cl2+H2O═HCl+HClO,则氯水中存在:Cl2、H2O、HClO、H+、Cl-、ClO-、OH-,
A.氯气与水反应生成HClO,HClO具有漂白性,可使有色布条褪色,故A正确;
B.反应Cl2+2OH-═Cl-+ClO-+H2O中氯气既是氧化剂也是还原剂,Cl元素化合价由0价变化为+1价、-1价,氧化剂与还原剂的物质的量之比为1:1,故B正确;
C.1mol Cl2与铁反应生成氯化铁,Cl元素化合价变为-1价,则得到2mol电子,故C错误;
D.亚铁离子与KSCN溶液不反应,则向某溶液中先滴加KSCN溶液无明显现象,再加新制氯水,呈血红色,则原溶液中一定有Fe2+,故D正确,
故选C.
点评 本题考查氯气的性质,为元素化合物知识的高频考点,有利于培养学生的良好的科学素养和学习的积极性,注意相关基础知识的积累,难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
5.Fe和Mg与H2SO4反应的实验如下:
关于上述实验说法不合理的是( )
实验 | 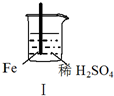 | 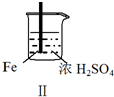 | 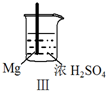 | 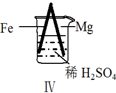 |
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
| A. | I中产生气体的原因是:Fe+2H+═Fe2++H2↑ | |
| B. | 取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体 | |
| C. | Ⅲ中现象说明Mg在浓H2SO4中没被钝化 | |
| D. | Ⅳ中现象说明Mg的金属性比Fe强 |
3.下列物质的分子中既有σ键又有π键的是( )
①NH3 ②HClO ③O2 ④H2O2 ⑤HCHO(甲醛) ⑥C2H2.
①NH3 ②HClO ③O2 ④H2O2 ⑤HCHO(甲醛) ⑥C2H2.
| A. | ③⑤⑥ | B. | ③④⑤⑥ | C. | ①③⑥ | D. | ①②③ |
10.对合金的性质或应用,下列说法不正确的是( )
| A. | 合金的硬度一般比它的各成分金属的小,多数合金的熔点一般也比它的各成分金属的高 | |
| B. | 合金在工业上具有比纯金属更广泛的用途 | |
| C. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| D. | 青铜是我国使用最早的合金 |
20.下列有关化学用语表示正确的是( )
| A. | 26Fe的原子结构示意图: | B. | 氮化硅的化学式:Si3N4 | ||
| C. | 基态氮原子的电子排布图: | D. | 29Cu的电子排布式:[Ar]3d94s2 |
7.下列离子方程式书写正确的是( )
| A. | 钠与水的反应 Na+H2O═OH-+H2↑ | |
| B. | NaHCO3溶液与盐酸的反应 CO32-+2H+═H2O+CO2↑ | |
| C. | 用FeCl3溶液腐蚀铜线路板 Cu+Fe3+═Cu2++Fe2+ | |
| D. | AlCl3溶液中加入过量氢氧化钠溶液 Al3++4OH-═AlO2-+2H2O |
4.下列化学用语的理解正确的是( )
| A. | 电子式: 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 离子结构示意图: 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| C. | 比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 聚丙烯的结构简式: |
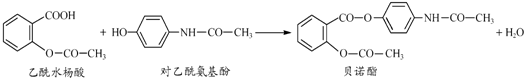
 .
.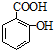 ,请写出两步反应中依次
,请写出两步反应中依次