题目内容
11.A3+微粒核外有46个电子,质量数为115,则A原子核里的中子数是( )| A. | 46 | B. | 66 | C. | 115 | D. | 49 |
分析 在阳离子中,阳离子的核外电子数=质子数-电荷数,质量数=质子数+中子数,所以中子数=质量数-质子数.
解答 解:A3+离子有46个电子,电荷数为3,阳离子的核外电子数=质子数-电荷数,所以质子数=核外电子数+电荷数=46+3=49;中子数=质量数-质子数=115-49=66,
故选B.
点评 本题考查了核外电子数、质子数、中子数、质量数、电荷数之间的关系,难度不大,明确由原子变成离子,变化的是核外电子数,不变的是核内质子数.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列有关金属及其化合物的叙述中,不正确的是( )
| A. | 钠是一种银白色的固体,钠的质地软,可用小刀切割 | |
| B. | 钠的化学性质很活泼,钠元素在于自然界只有化合态,无游离态 | |
| C. | 氢氧化铝碱性很强,可用于治疗胃酸过多 | |
| D. | 明矾与水反应生成的Al(OH)3胶体可以吸附水中悬浮的杂质,使水澄清,所以明矾可以作净水剂 |
19.下列各组离子,能大量共存于同一溶液中的是( )
| A. | CO32-、H+、Na+、NO3- | B. | H+、Ag+、Cl-、SO42- | ||
| C. | K+、Na+、OH-、NO3- | D. | Ba2+、Ca2+、SO42-、OH- |
6.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| B. | 常温常压下,11.2L二氧化硫中含有的氧原子数为NA | |
| C. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 标准状况下,22.4 L氦气与22.4 L氮气所含原子数均为2 NA |
16.下列有关二氧化硅的叙述中不正确的是( )
| A. | HF能用于刻蚀玻璃,制作玻璃量筒刻度 | |
| B. | SiO2是制光导纤维的主要原料 | |
| C. | 硅酸可由SiO2直接制得 | |
| D. | SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应 |
3.两种气态烃组成的混合气体0.1mol,完全燃烧得0.15mol CO2和3.6g H2O,下列关于该混合气体的说法正确的是( )
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有乙烷 | D. | 一定有甲烷 |
20.浓度均为0.1mol•L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )
| A. | BaCl2,NaOH,NaHCO3 | B. | Na2CO3,MgCl2,H2SO4 | ||
| C. | AgNO3,HCl,NaOH | D. | Ba(OH)2,CaCl2,Na2SO4 |
5.Fe和Mg与H2SO4反应的实验如下:
关于上述实验说法不合理的是( )
实验 | 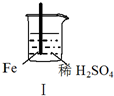 | 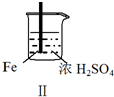 | 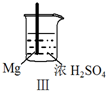 | 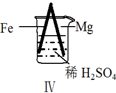 |
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
| A. | I中产生气体的原因是:Fe+2H+═Fe2++H2↑ | |
| B. | 取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体 | |
| C. | Ⅲ中现象说明Mg在浓H2SO4中没被钝化 | |
| D. | Ⅳ中现象说明Mg的金属性比Fe强 |