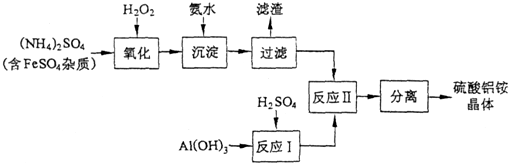
题目内容
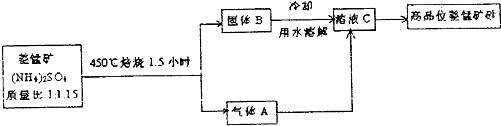
硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下: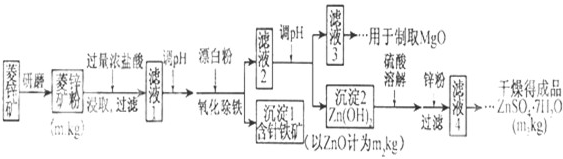
(1)将菱锌矿研磨成粉的目的是 .
(2)完成“氧化除铁”步骤中反应的离子方程式:□Fe(OH)2+□ +□ ═□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是 .
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为 .
(5)“滤液4”之后的操作依次为 、 、过滤,洗涤,干燥.
(6)抽滤装置如下图所示,该装置中的错误之处是 ;抽滤完毕或中途需停止抽滤时,应先 ,然后 .
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于 .

(1)将菱锌矿研磨成粉的目的是
(2)完成“氧化除铁”步骤中反应的离子方程式:□Fe(OH)2+□
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
(6)抽滤装置如下图所示,该装置中的错误之处是
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)根据影响化学反应速率的因素回答,固体表面积越大,反应速率越大;
(2)根据所加入物质的化学性质,根据质量守恒定律配平化学方程式;
(3)根据化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,来判断可能的组成;
(4)调节滤液2的pH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,以及Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH;
(5)根据从溶液中制得干燥纯净的固体一般有蒸发、结晶、过滤后洗涤并干燥等操作来回答;
(6)图中的两处错误为布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;吸滤完毕时,应先拆下连接抽气泵间的橡皮管,然后关闭水龙头,其原因是防止倒吸;
(7)利用关系式法来计算质量分数.
(2)根据所加入物质的化学性质,根据质量守恒定律配平化学方程式;
(3)根据化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,来判断可能的组成;
(4)调节滤液2的pH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,以及Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH;
(5)根据从溶液中制得干燥纯净的固体一般有蒸发、结晶、过滤后洗涤并干燥等操作来回答;
(6)图中的两处错误为布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;吸滤完毕时,应先拆下连接抽气泵间的橡皮管,然后关闭水龙头,其原因是防止倒吸;
(7)利用关系式法来计算质量分数.
解答:
解:(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分,故答案为:增大反应物接触面积或增大反应速率或使反应更充分;
(2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,反应的离子方程式为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-,
故答案为:2;1;ClO-;1;H2O;2;1;
(3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH),
故答案为:FeO(OH);
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,Mg(OH)2开始沉淀时的pH为10.4、Zn(OH)2开始沉淀时的pH为6.4,Mg(OH)2沉淀完全时的pH为12.4、Zn(OH)2沉淀完全时的pH8.0,所以理论上可选用的最大区间为8.0≤pH≤10.4;
故答案为:8.0≤pH≤10.4;
(5))“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥,
故答案为:蒸发浓缩;冷却结晶;
(6)图中的两处错误为布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;吸滤完毕时,应先拆下连接抽气泵间的橡皮管,然后关闭水龙头,其原因是防止倒吸;故答案为:布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;拆下连接抽气泵间的橡皮管;关闭水龙头;
(7)设碳酸锌的质量为m,利用关系式法计算:
ZnCO3----ZnO
125 81
m m2
ZnCO3的质量为
g,ZnCO3的质量分数为
×100%,故答案为:
×100%.
(2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,反应的离子方程式为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-,
故答案为:2;1;ClO-;1;H2O;2;1;
(3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH),
故答案为:FeO(OH);
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,Mg(OH)2开始沉淀时的pH为10.4、Zn(OH)2开始沉淀时的pH为6.4,Mg(OH)2沉淀完全时的pH为12.4、Zn(OH)2沉淀完全时的pH8.0,所以理论上可选用的最大区间为8.0≤pH≤10.4;
故答案为:8.0≤pH≤10.4;
(5))“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥,
故答案为:蒸发浓缩;冷却结晶;
(6)图中的两处错误为布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;吸滤完毕时,应先拆下连接抽气泵间的橡皮管,然后关闭水龙头,其原因是防止倒吸;故答案为:布氏漏斗的斜面应朝向吸滤瓶的支管口,安全瓶内应短管进长管出;拆下连接抽气泵间的橡皮管;关闭水龙头;
(7)设碳酸锌的质量为m,利用关系式法计算:
ZnCO3----ZnO
125 81
m m2
ZnCO3的质量为
| 125m 2 |
| 81 |
| 125m2 |
| 81m1 |
| 125m2 |
| 81m1 |
点评:本题是流行的化工工艺流程题,主要依据流程图中涉及的化学知识、化学原理来设计问题.能够将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下列实验装置一般不用于分离物质的是( )
A、 |
B、 |
C、 |
D、 |