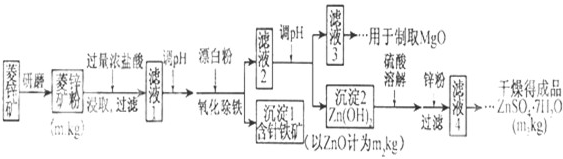
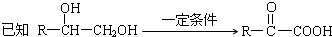
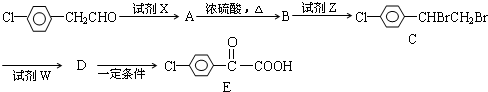
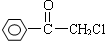题目内容
用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式.
(1)BaCl2(HCl)试剂 ,离子方程式: .
(2)CO2(HCl)试剂 ,离子方程式: .
(3)O2(CO2)试剂 ,离子方程式: .
(4)SO42-(CO32-) 试剂 ,离子方程式: .
(1)BaCl2(HCl)试剂
(2)CO2(HCl)试剂
(3)O2(CO2)试剂
(4)SO42-(CO32-) 试剂
考点:物质的分离、提纯和除杂,离子方程式的书写
专题:
分析:(1)可选用BaCO3除去HCl;
(2)HCl与碳酸氢钠反应生成二氧化碳;
(3)二氧化碳是酸性气体,可选用强碱除去;
(4)硫酸的酸性比碳酸强,可选用硫酸除去碳酸根离子.
(2)HCl与碳酸氢钠反应生成二氧化碳;
(3)二氧化碳是酸性气体,可选用强碱除去;
(4)硫酸的酸性比碳酸强,可选用硫酸除去碳酸根离子.
解答:
解:(1)除杂不能引入新的杂质,故可选用BaCO3除去HCl,离子方程式为:BaCO3+2H+═Ba2++H2O+CO2↑,故答案为:BaCO3,BaCO3+2H+═Ba2++H2O+CO2↑;
(2)HCl与碳酸氢钠反应生成二氧化碳,则选择试剂为饱和NaHCO3溶液,发生的离子反应为HCO3-+H+═H2O+CO2↑,
故答案为:饱和NaHCO3溶液;HCO3-+H+═H2O+CO2↑;
(3)二氧化碳是酸性气体,可选用NaOH溶液除去;离子方程式为:2OH-+CO2═CO32-+H2O,故答案为:NaOH溶液、2OH-+CO2═CO32-+H2O;
(4)硫酸的酸性比碳酸强,可选用稀硫酸除去碳酸根离子,离子方程式为:CO32-+2H+═H2O+CO2↑,故答案为:稀硫酸、CO32-+2H+═H2O+CO2↑.
(2)HCl与碳酸氢钠反应生成二氧化碳,则选择试剂为饱和NaHCO3溶液,发生的离子反应为HCO3-+H+═H2O+CO2↑,
故答案为:饱和NaHCO3溶液;HCO3-+H+═H2O+CO2↑;
(3)二氧化碳是酸性气体,可选用NaOH溶液除去;离子方程式为:2OH-+CO2═CO32-+H2O,故答案为:NaOH溶液、2OH-+CO2═CO32-+H2O;
(4)硫酸的酸性比碳酸强,可选用稀硫酸除去碳酸根离子,离子方程式为:CO32-+2H+═H2O+CO2↑,故答案为:稀硫酸、CO32-+2H+═H2O+CO2↑.
点评:本题考查离子反应的书写,明确发生的化学反应是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
2-氯丙烷跟氢氧化钠的醇溶液共热后,生成的产物再与溴水反应,得到的产物的同分异构体有( )
| A、2种 | B、4种 | C、3种 | D、5种 |
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )


| A、此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B、此过程中铜并不被腐蚀 |
| C、此过程中电子从Fe移向Cu |
| D、正极电极反应式为:2H++2e-=H2↑ |