题目内容
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:

I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气.
己知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)过程I 加入铁屑的主要作用是 ,从固体B中分离出铜需采用的方法是 ;
(2)过程II中发生反应的化学方程式为 ,调节溶液的pH为5,金属离子浓度为 .(列式计算)
(3)FeCl3的水溶液呈 性(填“酸”、“碱”、“中”),原因是 (用离子方程式表示),在④过程中应如何操作 .

I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气.
己知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)过程I 加入铁屑的主要作用是
(2)过程II中发生反应的化学方程式为
(3)FeCl3的水溶液呈
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:废液含有氯化铁、氯化铜,加入试剂Ⅰ为过量铁,发生反应生成氯化亚铁和铜,过滤得到固体B为Cu和Fe,滤液A加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气,反应生成氢氧化铁,过滤得到固体D加入稀盐酸溶解得到溶液E,通过蒸发浓缩,冷却结晶过滤洗涤得到氯化铁晶体.
解答:
解:(1)过程I 加入铁屑的主要作用是,利用铁和铁离子反应生成亚铁离子,和铜离子反应生成金属铜,过滤得到固体B为Fe和Cu,加入稀盐酸过滤得到铜;
故答案为:回收铜;加盐酸后过滤;
(2)过程II中发生反应是向滤液中加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气,氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁,氢氧化亚铁和空气中的氧气反应生成氢氧化铁,反应的化学方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4 Fe(OH)3,调节溶液的pH为5,金属离子浓度为C(Fe3+)=
=4.0×10-11;
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4 Fe(OH)3;C(Fe3+)=
=4.0×10-11;
(3)FeCl3的水溶液中铁离子水解显酸性,反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,氯化铁溶液得到氯化铁晶体,需要防止铁离子水解,应在稀盐酸或氯化氢气流中加热蒸发浓缩结晶过滤得到晶体;
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;在盐酸溶液中或氯化氢气流中浓缩结晶并过滤.
故答案为:回收铜;加盐酸后过滤;
(2)过程II中发生反应是向滤液中加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气,氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁,氢氧化亚铁和空气中的氧气反应生成氢氧化铁,反应的化学方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4 Fe(OH)3,调节溶液的pH为5,金属离子浓度为C(Fe3+)=
| Ksp |
| c3(OH-) |
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4 Fe(OH)3;C(Fe3+)=
| Ksp |
| c3(OH-) |
(3)FeCl3的水溶液中铁离子水解显酸性,反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,氯化铁溶液得到氯化铁晶体,需要防止铁离子水解,应在稀盐酸或氯化氢气流中加热蒸发浓缩结晶过滤得到晶体;
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;在盐酸溶液中或氯化氢气流中浓缩结晶并过滤.
点评:本题考查了物质分离提纯的分析流程的理解应用,掌握物质性质是关键,题目较简单.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 |
| B、用排水集气法便可以收集到纯净的氯气 |
| C、干燥的氯气有漂白性 |
| D、自来水常用氯气来杀菌、消毒 |
四种短周期元素W、X、Y、Z 的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子核的质子数之比为1:2,X和Y的电子数之差为4.下列说法正确的是( )
| A、原子半径大小:Z>Y>X>W |
| B、由W元素形成的单质一定是原子晶体,其熔沸点很高 |
| C、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
| D、Y、Z所形成的氧化物的水化物的酸性为:Y<Z |
下列物质不能通过化合反应直接制得的是( )
| A、FeCl2 |
| B、NaHSO3 |
| C、Cu(OH)2 |
| D、Na2O2 |
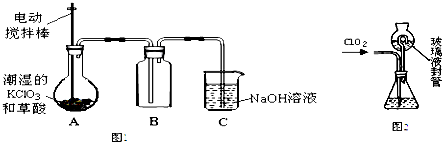
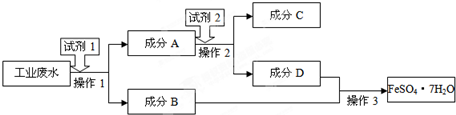
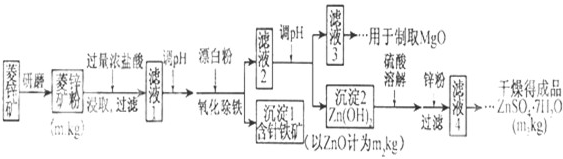

 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成,其中一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成,其中一种合成路线如下: