题目内容
在NH4Cl饱和溶液中分别加入Mg、NH4Cl、NH4HCO3、H2O、氯水、Cu,能使该溶液的pH增大的是 .
考点:盐类水解的原理
专题:
分析:在NH4Cl饱和溶液中存在NH4++H2O?NH3.H2O+H+,
加入的物质如果能和H+反应,则促进氯化铵水解,溶液中c(H+)降低,pH增大;
如果加入的物质不影响NH4+水解,则溶液的pH不变;
如果加入的物质抑制NH4+水解,则溶液中c(H+)减小,溶液的pH增大;
如果加入的物质导致溶液中c(H+)增大,则溶液的pH减小,据此分析解答.
加入的物质如果能和H+反应,则促进氯化铵水解,溶液中c(H+)降低,pH增大;
如果加入的物质不影响NH4+水解,则溶液的pH不变;
如果加入的物质抑制NH4+水解,则溶液中c(H+)减小,溶液的pH增大;
如果加入的物质导致溶液中c(H+)增大,则溶液的pH减小,据此分析解答.
解答:
解:NH4Cl饱和溶液中存在NH4++H2O?NH3.H2O+H+,
①Mg可以H+反应:Mg+2H+=Mg2++H2↑,氢离子参加反应导致c(H+)降低,pH增大;
②饱和的NH4Cl溶液继续加入NH4Cl固体,NH4Cl不溶解导致溶液中c(H+)不变,所以理论上不会影响溶液pH值;
③加入NH4HCO3,由于H2CO3的酸性比盐酸弱,所以其溶液中水解生成的碳酸酸性比盐酸弱,因此溶液的pH值就会比较高,往NH4Cl中加入它就会使pH值升高;
④加入大量的水后,促进NH4Cl水解,但NH4Cl水解增大程度小于溶液体积增大程度,所以溶液中c(H+)降低,pH增大;
⑤氯水是酸性的,且酸性大于NH4Cl溶液,加入后溶液中c(H+)增大,则溶液的pH值会下降;
⑥Cu不与NH4Cl反应,所以不影响NH4Cl水解,溶液中c(H+)不变,则pH值理论上没影响,
所以能使该溶液的pH增大的是Mg、NH4HCO3、H2O,
故答案为:Mg、NH4HCO3、H2O.
①Mg可以H+反应:Mg+2H+=Mg2++H2↑,氢离子参加反应导致c(H+)降低,pH增大;
②饱和的NH4Cl溶液继续加入NH4Cl固体,NH4Cl不溶解导致溶液中c(H+)不变,所以理论上不会影响溶液pH值;
③加入NH4HCO3,由于H2CO3的酸性比盐酸弱,所以其溶液中水解生成的碳酸酸性比盐酸弱,因此溶液的pH值就会比较高,往NH4Cl中加入它就会使pH值升高;
④加入大量的水后,促进NH4Cl水解,但NH4Cl水解增大程度小于溶液体积增大程度,所以溶液中c(H+)降低,pH增大;
⑤氯水是酸性的,且酸性大于NH4Cl溶液,加入后溶液中c(H+)增大,则溶液的pH值会下降;
⑥Cu不与NH4Cl反应,所以不影响NH4Cl水解,溶液中c(H+)不变,则pH值理论上没影响,
所以能使该溶液的pH增大的是Mg、NH4HCO3、H2O,
故答案为:Mg、NH4HCO3、H2O.
点评:本题考查水解平衡原理,明确加入物质对c(H+)的影响是解本题关键,注意加水稀释虽然促进氯化铵水解但溶液的pH增大,为易错点.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列化学用语或模型图正确的是( )
| A、HClO的结构式:H-Cl-O |
B、CO2的比例模型: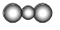 |
C、146C的原子结构示意图: |
D、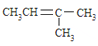 的名称:3-甲基-2-丁烯 的名称:3-甲基-2-丁烯 |
下列说法中正确的是( )
| A、用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 |
| B、用排水集气法便可以收集到纯净的氯气 |
| C、干燥的氯气有漂白性 |
| D、自来水常用氯气来杀菌、消毒 |