题目内容
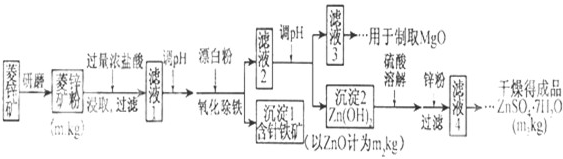
已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石.有人设计了把我国的菱锰矿(MnCO3)(贫矿)转化为高品位“菱锰矿砂”的绿色工艺.该工艺流程如图所示: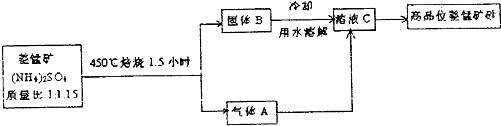
回答下列问题:
(1)锰元素位于元素周期中第 周期 族.
(2)气体A中含有两种气体,溶液C与气体A发生反应的化学方程式为
(3)锰的化合物用途广泛,例如MnO2KMnO4都是重要的锰化合物MnO2可用于制备KMnO4,一般是先由MnO2在碱性条件下与O2反应制备得到K2MnO4,再由K2MnO4制备KMnO4.写出MnO2得到K2MnO4的化学方程式 .

回答下列问题:
(1)锰元素位于元素周期中第
(2)气体A中含有两种气体,溶液C与气体A发生反应的化学方程式为
(3)锰的化合物用途广泛,例如MnO2KMnO4都是重要的锰化合物MnO2可用于制备KMnO4,一般是先由MnO2在碱性条件下与O2反应制备得到K2MnO4,再由K2MnO4制备KMnO4.写出MnO2得到K2MnO4的化学方程式
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)根据元素在元素周期表中的分布结合元素的原子结构来回答;
(2)铵盐受热分解生成氨气,碳酸锰高温分解得到二氧化碳气体,氨气极易溶于水,得到的溶液显示碱性,可以和二氧化碳反应得到碳酸铵;
(3)根据题目信息:由MnO2在碱性条件下与O2反应制备得到K2MnO4来书写方程式.
(2)铵盐受热分解生成氨气,碳酸锰高温分解得到二氧化碳气体,氨气极易溶于水,得到的溶液显示碱性,可以和二氧化碳反应得到碳酸铵;
(3)根据题目信息:由MnO2在碱性条件下与O2反应制备得到K2MnO4来书写方程式.
解答:
解:把我国的菱锰矿(MnCO3)(贫矿)转化为高品位“菱锰矿砂”的绿色工艺流程为:高温下焙烧菱锰矿时,硫酸铵盐热分解生成氨气,碳酸锰高温分解得到二氧化碳气体,将产生的固体溶于水,可以得到硫酸锰溶液,在水溶液中,两种气体和硫酸锰之间反应生成碳酸锰,
(1)金属锰是25号元素,原子核外电子排布是:2、8、8、7,属于VIIB元素,原子核外电子四层,位于第四周期,故答案为:四;VIIB;
(2)硫酸铵铵盐受热分解生成氨气,碳酸锰高温分解得到二氧化碳气体,在水溶液中,两种气体和硫酸锰之间的反应为:MnSO4+2NH3+CO2+H2O=MnCO3↓+(NH4)2SO4,
故答案为:MnSO4+2NH3+CO2+H2O=MnCO3↓+(NH4)2SO4;
(3)根据题目信息:由MnO2在碱性条件下与O2反应制备得到K2MnO4,则反应为:2MnO2+4KOH+O2=2K2MnO4+2H2O,故答案为:2MnO2+4KOH+O2=2K2MnO4+2H2O.
(1)金属锰是25号元素,原子核外电子排布是:2、8、8、7,属于VIIB元素,原子核外电子四层,位于第四周期,故答案为:四;VIIB;
(2)硫酸铵铵盐受热分解生成氨气,碳酸锰高温分解得到二氧化碳气体,在水溶液中,两种气体和硫酸锰之间的反应为:MnSO4+2NH3+CO2+H2O=MnCO3↓+(NH4)2SO4,
故答案为:MnSO4+2NH3+CO2+H2O=MnCO3↓+(NH4)2SO4;
(3)根据题目信息:由MnO2在碱性条件下与O2反应制备得到K2MnO4,则反应为:2MnO2+4KOH+O2=2K2MnO4+2H2O,故答案为:2MnO2+4KOH+O2=2K2MnO4+2H2O.
点评:本题是一道物质的分离和提纯的实验方案设计探究题,考查学生实验分析能力和解决问题的能力,难度中等.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
四种短周期元素W、X、Y、Z 的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子核的质子数之比为1:2,X和Y的电子数之差为4.下列说法正确的是( )
| A、原子半径大小:Z>Y>X>W |
| B、由W元素形成的单质一定是原子晶体,其熔沸点很高 |
| C、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
| D、Y、Z所形成的氧化物的水化物的酸性为:Y<Z |
2-氯丙烷跟氢氧化钠的醇溶液共热后,生成的产物再与溴水反应,得到的产物的同分异构体有( )
| A、2种 | B、4种 | C、3种 | D、5种 |
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2═N2O4△H<0)下列叙述正确的是( )
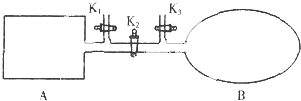

| A、到达平衡时A和B中NO2气体体积分数相同 |
| B、若在A、B中再充入与初始量相等的NO2,则达到平衡时A、B中NO2转化率都增大 |
| C、若气球的体积不再改变,表明B中反应已达到平衡 |
| D、室温下,若设法使A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时B中气体的颜色较深 |
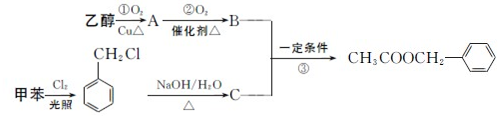
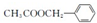 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成,其中一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成,其中一种合成路线如下: