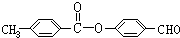题目内容
4.如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )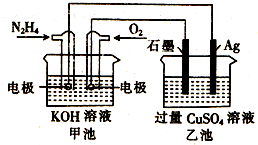
| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池中负极反应为N2H4-4e-=N2+4H+ | |
| C. | 甲池和乙池中的溶液的pH均减小 | |
| D. | 当甲池中消耗0.1mol N2H4时,乙池中理论上最多产生6.4g固体 |
分析 甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-,乙池为电解池,阴极电极反应为 Cu2++2e-=Cu、阳极反应为4OH--4e-=2H2O+O2↑,据此分析解答.
解答 解:甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-,乙池为电解池,阴极电极反应为 Cu2++2e-=Cu、阳极反应为4OH--4e-=2H2O+O2↑,
A.通入肼的电极为负极,负极与阴极相连,银极为阴极,铜离子得电子生成铜单质,故A错误;
B.甲池负极反应为N2H4-4e-+4OH-=N2+4H2O,氢离子不能在碱性溶液中出现,故B错误;
C.甲池生成水,导致溶液中KOH浓度降低,则溶液pH减小,乙池中氢氧根离子放电,导致溶液pH减小,故C正确;
D.甲池N2H4-4e-+4OH-=N2+4H2O,消耗0.1mol N2H4时,转移0.4mol电子,乙池Cu2++2e-=Cu,产生0.2mol铜,为12.8g固体,故D错误;
故选C.
点评 本题考查了原电池和电解池原理,根据电极反应确定电极上的生成物及溶液pH变化,难点是电极反应式的书写及计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.一种石墨烯锂硫电池(2Li+S8═Li2S8)工作原理示意如图.下列有关该电池说法正确的是( )
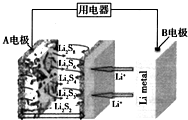

| A. | B电极为正极 | |
| B. | A电极上的电极反应式为:2Li++S8+2e-═Li2S8 | |
| C. | 每生成1molLi2S8转移0.25 mol电子 | |
| D. | 给该电池充电时,A电极连接电源的负极 |
19.下列有关物质性质或应用的说法正确的是( )
| A. | 二氧化锰具有强氧化性,可作双氧水分解的氧化剂 | |
| B. | 浓硫酸具有较强酸性,常用作淀粉水解的催化剂 | |
| C. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果更好 |
16.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
13.下列说法中正确的是( )
①用蒸馏的方法来分离甲苯、溴苯和辛烷的混合物
②石油分馏可得到汽油、煤油等,重整可得到芳香烃
③裂化汽油可使溴水褪色
④裂解的目的是获得乙烯、丙烯、丁二烯等气态烯烃
⑤聚乙烯可发生加成反应
⑥1-氯丙烷和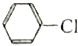 的水解反应均有醇生成.
的水解反应均有醇生成.
①用蒸馏的方法来分离甲苯、溴苯和辛烷的混合物
②石油分馏可得到汽油、煤油等,重整可得到芳香烃
③裂化汽油可使溴水褪色
④裂解的目的是获得乙烯、丙烯、丁二烯等气态烯烃
⑤聚乙烯可发生加成反应
⑥1-氯丙烷和
 的水解反应均有醇生成.
的水解反应均有醇生成.| A. | 全都正确 | B. | 除⑤ | C. | 除⑥ | D. | ①②③④ |
14.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 3.1g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1mol丙烯醛中含有双键的数目为0.1NA | |
| C. | 标准状况下,2.24L乙醇中含有的分子数目为0.1NA | |
| D. | 1molNaHSO4固体中阳离子的数目为2NA |
 ②KCl
②KCl (3)H2O2
(3)H2O2 ;
;
 .
. .
.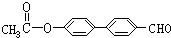 、
、