题目内容
13.下列说法中正确的是( )①用蒸馏的方法来分离甲苯、溴苯和辛烷的混合物
②石油分馏可得到汽油、煤油等,重整可得到芳香烃
③裂化汽油可使溴水褪色
④裂解的目的是获得乙烯、丙烯、丁二烯等气态烯烃
⑤聚乙烯可发生加成反应
⑥1-氯丙烷和
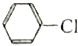 的水解反应均有醇生成.
的水解反应均有醇生成.| A. | 全都正确 | B. | 除⑤ | C. | 除⑥ | D. | ①②③④ |
分析 ①甲苯、溴苯和辛烷的沸点不同;
②石油分馏石油分馏可得到汽油、煤油等,石油的催化重整可得到芳香烃等;
③裂化汽油中含有烯烃;
④裂解的目的得到更多气态烯烃等化工原料;
⑤聚乙烯不含不饱和键,不能发生加成反应;
⑥氯苯发生水解反应生成苯酚.
解答 解:①甲苯、溴苯和辛烷的沸点不同,可采用蒸馏的方法实现甲苯、溴苯和辛烷的混合物中三者的分离,故①正确;
②石油分馏石油分馏可得到汽油、煤油等,石油的催化重整可得到芳香烃等,故②正确;
③裂化汽油中含有烯烃,烯烃中含有碳碳双键,能使溴水褪色,故③正确
④石油裂解的目的是为了获得短链的不饱和烃,即乙烯、丙烯和1,3-丁二烯等,故④正确;
⑤聚乙烯不含不饱和键,不能发生加成反应,故⑤错误;
⑥氯苯发生水解反应生成苯酚,不是醇,故⑥错误;
故选D.
点评 本题考查石油的综合利用,涉及石油的分馏、裂化和裂解,是高频考点,注意聚乙烯不再含有碳碳双键.

练习册系列答案
相关题目
3.短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )
| A. | 原子半径C>D>E,三者形成的简单离子中D离子的半径最小 | |
| B. | 元素A所形成的氢化物常温下一定为气态 | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
4.如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
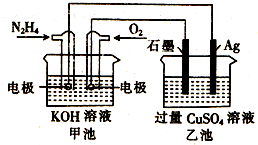

| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池中负极反应为N2H4-4e-=N2+4H+ | |
| C. | 甲池和乙池中的溶液的pH均减小 | |
| D. | 当甲池中消耗0.1mol N2H4时,乙池中理论上最多产生6.4g固体 |
1.如图实验现象预测正确的是( )
| A. | 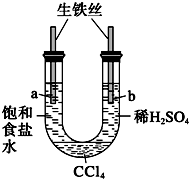 一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 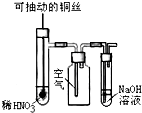 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 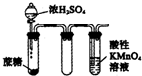 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
8.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 往蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热,能看到银镜生成 | |
| C. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| D. | 向鸡蛋清溶液中加硫酸铵饱和溶液,有沉淀析出,再加水沉淀溶解 |
5.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿[主要成分是钛酸亚铁(FeTiO3),含有Fe(Ⅲ)等杂质],同时获得副产品甲的工业生产流程如下:
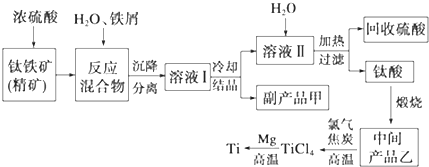
(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化成Fe3+,可循环利用的物质是硫酸,检验副产品甲是否变质的实验方法是取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于10时,Mg(OH)2开始沉淀
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O=TiO(OH)2↓+2H+.
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是隔绝空气,反应后的产物需要加入稀盐酸(或稀硫酸)溶解后才能达到提纯金属钛的目的.

(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化成Fe3+,可循环利用的物质是硫酸,检验副产品甲是否变质的实验方法是取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O=TiO(OH)2↓+2H+.
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是隔绝空气,反应后的产物需要加入稀盐酸(或稀硫酸)溶解后才能达到提纯金属钛的目的.
2.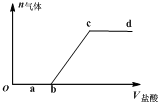 向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
 向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应溶液中:Ca2+、Mg2+、Br-、NO3- | |
| B. | b点对应溶液中:Al3+、Fe3+、MnO4-、NO3- | |
| C. | c点对应溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应溶液中:F-、NO3-、Fe2+、Ag+ |
3.将N2、H2的混合气体分别充入甲、乙、丙三个容器后,测得化学反应速率分别为甲:v(H2)=3mol/(L•min);乙:v(N2)=2mol/(L•min);丙:v(NH3)=1mol/(L•S).则三个容器中合成氨的反应速率( )
| A. | v(甲)>v(乙)>v(丙) | B. | v(乙)>v(丙)>v(甲) | C. | v(丙)>v(乙)>v(甲) | D. | v(乙)>v(甲)>v(丙) |