题目内容
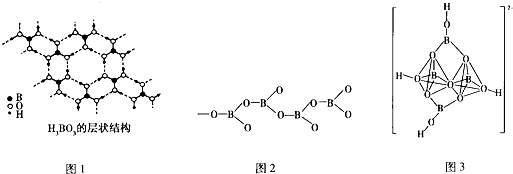
12.一种石墨烯锂硫电池(2Li+S8═Li2S8)工作原理示意如图.下列有关该电池说法正确的是( )
| A. | B电极为正极 | |
| B. | A电极上的电极反应式为:2Li++S8+2e-═Li2S8 | |
| C. | 每生成1molLi2S8转移0.25 mol电子 | |
| D. | 给该电池充电时,A电极连接电源的负极 |
分析 在原电池中,电解质里的阳离子移向正极,所以A是正极,发生还原反应:2Li++S8+2e-═Li2S8,电子从原电池的负极流向正极,根据电极反应式结合电子转移进行计算即可.
解答 解:A、在原电池中,电解质里的阳离子移向正极,所以A是正极,故A错误;
B、A是正极,发生得电子的还原反应:2Li++S8+2e-═Li2S8,故B正确;
C、正极反应式:2Li++S8+2e-═Li2S8,每生成1molLi2S8转移2mol电子,故C错误;
D、充电时A极与正极相连,故D错误.
故选B.
点评 本题考查化学电源新型电池,题目难度中等,注意把握原电池的工作原理和电极反应的判断.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
2.25℃时,Ksp(AgC1)=1.8×10-10,Ksp(AgI)=8.5×10-17,则下列说法正确的是( )
| A. | 向饱和AgCl水溶液中加入盐酸,Ksp(AgC1)变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 温度一定,当溶液中c(Ag+)c(Cl- )<Ksp(AgCl)时,此溶液中必有AgCl沉淀析出 | |
| D. | 向AgI的悬浊液中加NaCl浓溶液,可能有AgCl生成 |
3.短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )
| A. | 原子半径C>D>E,三者形成的简单离子中D离子的半径最小 | |
| B. | 元素A所形成的氢化物常温下一定为气态 | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
4.如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
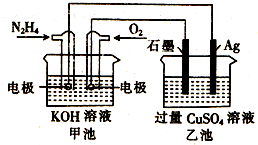

| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池中负极反应为N2H4-4e-=N2+4H+ | |
| C. | 甲池和乙池中的溶液的pH均减小 | |
| D. | 当甲池中消耗0.1mol N2H4时,乙池中理论上最多产生6.4g固体 |
1.如图实验现象预测正确的是( )
| A. | 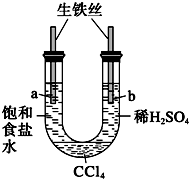 一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 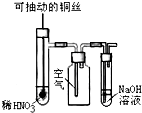 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 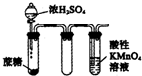 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
2.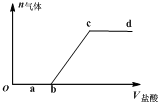 向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
 向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应溶液中:Ca2+、Mg2+、Br-、NO3- | |
| B. | b点对应溶液中:Al3+、Fe3+、MnO4-、NO3- | |
| C. | c点对应溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应溶液中:F-、NO3-、Fe2+、Ag+ |
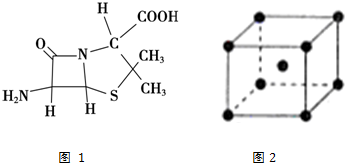
 .
.