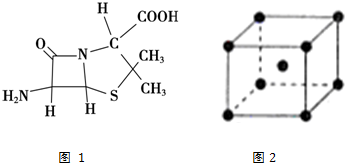
题目内容
16.几种短周期元素的原子半径及主要化合价如表:| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
分析 短周期元素中,W只有-2价,则W为O元素,Z有+6、+4、-2价,原子半径大于O元素,二者应同主族,故Z为S元素;X、Y的化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径与O相差很大,应处于第三周期,故X为Mg、Y为Al,结合元素单质化合物的性质及元素周期律进行解答.
解答 解:A.同周期自左而右金属性减弱,故金属性Mg>Al,故A错误;
B.一定条件下,硫与氧气反应可以生成二氧化硫,故B错误;
C.氧化铝对应的水化物氢氧化铝是一种是弱酸,故C错误;
D.一定条件下,氧气与氨气反应可以生成氮气与水,故D正确;
故选:D.
点评 本题考查结构性质位置关系应用,难度中等,根据化合价及原子半径推断元素是解题关键,注意对元素周期律及元素化合物性质的理解掌握.

练习册系列答案
相关题目
6.S2Cl2是工业上常用的硫化剂,是一种金黄色液体.
已知:①S2Cl2不稳定,进一步氧化可得SCl2
②S2Cl2和SCl2 都与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+64HCl
③几种物质的熔沸点如表:
如图是实验室中通过向熔融的单质硫中通入少量Cl2制取S2Cl2的装置(部分夹持、加热装置已略去)
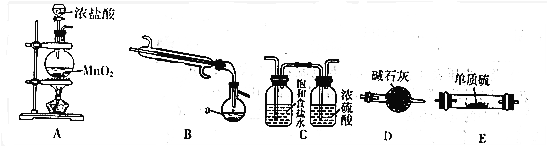
(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2时,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验验证所得产品中是否含有杂质SCl2:取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
已知:①S2Cl2不稳定,进一步氧化可得SCl2
②S2Cl2和SCl2 都与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+64HCl
③几种物质的熔沸点如表:
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |

(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2时,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验验证所得产品中是否含有杂质SCl2:取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
4.如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
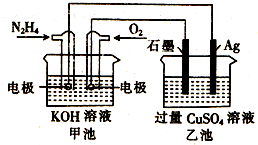

| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池中负极反应为N2H4-4e-=N2+4H+ | |
| C. | 甲池和乙池中的溶液的pH均减小 | |
| D. | 当甲池中消耗0.1mol N2H4时,乙池中理论上最多产生6.4g固体 |
11.把5molA和6molB的混合气体通入4L的密闭容器中,在一定条件下发生如下反应:5A(g)+4B(g)?6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1mol•L-1•min-1.下列计算结果正确的是( )
| A. | x的数值是2 | |
| B. | A的转化率为50% | |
| C. | B的平衡浓度为2mol/L | |
| D. | 反应前后混合气体的压强之比为22:25 |
1.如图实验现象预测正确的是( )
| A. | 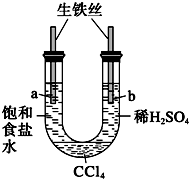 一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 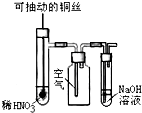 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 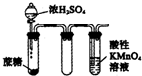 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
8.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 往蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热,能看到银镜生成 | |
| C. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| D. | 向鸡蛋清溶液中加硫酸铵饱和溶液,有沉淀析出,再加水沉淀溶解 |
5.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿[主要成分是钛酸亚铁(FeTiO3),含有Fe(Ⅲ)等杂质],同时获得副产品甲的工业生产流程如下:
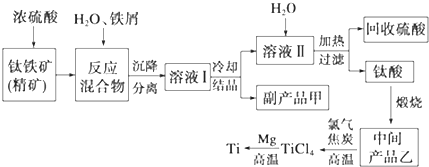
(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化成Fe3+,可循环利用的物质是硫酸,检验副产品甲是否变质的实验方法是取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于10时,Mg(OH)2开始沉淀
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O=TiO(OH)2↓+2H+.
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是隔绝空气,反应后的产物需要加入稀盐酸(或稀硫酸)溶解后才能达到提纯金属钛的目的.

(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化成Fe3+,可循环利用的物质是硫酸,检验副产品甲是否变质的实验方法是取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O=TiO(OH)2↓+2H+.
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是隔绝空气,反应后的产物需要加入稀盐酸(或稀硫酸)溶解后才能达到提纯金属钛的目的.
6.按表中所述内容进行实验,可以实现相应的实验目的是( )
| 选项 | 甲中试剂 | 乙中试剂 | 气体成份及实验目的 | 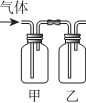 |
| A | NaHSO3溶液 | 硅酸钠溶液 | HCl:证明非金属Cl>S>Si | |
| B | FeI2淀粉溶液 | FeI2、KSCN溶液 | Cl2:验证氧化性Cl2>Fe3+>I2 | |
| C | 溴水 | AgNO3溶液 | 乙烯:验证溴水与乙烯发生的是加成反应 | |
| D | Ba(OH)2溶液 | 品红溶液 | 验证混合气体中含有SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |