题目内容
3.草酸是中强酸,草酸氢钾溶液呈酸性.在0.1mol/L KHC2O4溶液中,下列关系正确的是( )①c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
②c(HC2O4-)+c(C2O42-)=0.1mol/L
③c(C2O4-)>c(H2C2O4)
④c(K+)=c(H2C2O4)+c (HC2O4-)+c(C2O42-)
| A. | ①② | B. | ①④ | C. | ③④ | D. | ②③ |
分析 草酸是中强酸,则KHC2O4是二元弱酸酸式盐,草酸氢钾溶液呈酸性,说明HC2O4-的电离程度大于水解程度导致溶液呈酸性,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:草酸是中强酸,则KHC2O4是二元弱酸酸式盐,草酸氢钾溶液呈酸性,说明HC2O4-的电离程度大于水解程度导致溶液呈酸性,溶液中存在电荷守恒和物料守恒,
因为草酸氢根离子水解和电离导致溶液中含有C元素的微粒有H2C2O4、HC2O4-、C2O4-,
①根据电荷守恒得c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故错误;
②溶液中含有C元素的微粒有H2C2O4、HC2O4-、C2O4-,
根据物料守恒得c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol/L,故错误;
③草酸氢根离子电离程度大于水解程度,所以c(C2O42-)>c(H2C2O4),故正确;
④根据物料守恒得c(K+)=c(H2C2O4)+c (HC2O4-)+c(C2O42-),故正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,侧重考查学生分析判断能力,难点是正确获取信息并灵活运用,会正确使用溶液中存在的守恒,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
13.下列各组中的反应,不属于同一反应类型的是( )
| A. | 乙醇在一定条件下转化为乙醛,交警用K2Cr2O7检查司机是否酒驾 | |
| B. | 由甲苯硝化制对硝基甲苯,由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| C. | 乙醇分子间脱水成乙醚,溴乙烷在一定条件下脱去HCl成乙烯 | |
| D. | 油酸甘油酯通过氢化反应转变为硬脂酸甘油酯,由丙烯与水反应制丙醇 |
14.对于某一化学反应,下列各项反应条件改变,能增大单位体积内活化分子百分数,降低化学反应的活化能,从而提高反应速率的是( )
| A. | 增大反应物浓度 | B. | 加压 | C. | 升温 | D. | 加催化剂 |
11.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 碱性氧化物:氧化铁(Fe3O4) | B. | 酸性氧化物:二氧化碳(CO2) | ||
| C. | 碱性氧化物:(Na2O2) | D. | 碱:纯碱(Na2CO3) |
4.一种烃的结构可表示为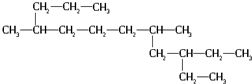 ,用系统命名法命名,该烃的名称为( )
,用系统命名法命名,该烃的名称为( )
 ,用系统命名法命名,该烃的名称为( )
,用系统命名法命名,该烃的名称为( )| A. | 4,8-二甲基-10-乙基12烷 | B. | 5,9-二甲基-3-乙基十二烷 | ||
| C. | 5-甲基-3-乙基-9-丙基十一烷 | D. | 3,9-二甲基-4-乙基十二烷 |
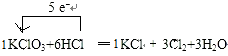 .
.
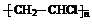 ,GHOOC(CH2)4COOH.
,GHOOC(CH2)4COOH.