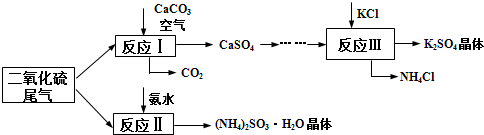
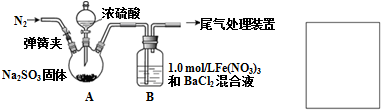
题目内容
8.有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取0.442g灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成0.200g沉淀,过滤后的残渣能与30mL盐酸恰好完全反应.试求:(1)原白色粉末中各物质的质量.
(2)所用盐酸的物质的量浓度.
分析 (1)加热无水碳酸钠和碳酸氢钠的混合物,发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,生成的二氧化碳与氢氧化钙溶液反应生成0.2g碳酸钙,根据n=$\frac{m}{n}$计算碳酸钙的物质的量,利用碳元素守恒计算二氧化碳的物质的量,根据方程式计算原混合物中碳酸氢钠的物质的量,根据m=nM计算碳酸氢钠的质量,进而计算碳酸钠的质量;
(2)灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒有n(HCl)=n(NaCl),再根据c=$\frac{n}{V}$计算盐酸的浓度
解答 解:(1)0.2g碳酸钙的物质的量为$\frac{0.2g}{100g/mol}$=0.002mol,根据碳元素守恒可知,n(CO2)=n(CaCO3)=0.002mol,加热无水碳酸钠和碳酸氢钠的混合物,发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,由方程式可知,
n(NaHCO3)=2n(CO2)=0.002mol×2=0.004mol,故碳酸氢钠的质量为0.004mol×84g/mol=0.336g,
故碳酸钠的质量为0.442g-0.336g=0.106g,
答:原混合物中碳酸氢钠的质量为0.336g,碳酸钠的质量为0.106g;
(2)原混合物中n(NaHCO3)=0.004mol,n(Na2CO3)=$\frac{0.106g}{106g/mol}$=0.001mol,灼烧后的残渣为碳酸钠,能与30mL盐酸恰好完全反应生成NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒有n(HCl)=n(NaCl),故n(HCl)=n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.001mol×2+0.004mol=0.006mol,故盐酸的物质的量浓度为$\frac{0.006mol}{0.03L}$=0.2mol/L,
答:盐酸的物质的量浓度为0.2mol/L.
点评 本题考查混合物的有关计算,难度不大,清楚发生的反应是关键,注意根据元素守恒进行的计算.

| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | CH4 |
| A. | 构成原电池的正极和负极必须是两种不同的金属 | |
| B. | 原电池工作时,外电路中电流的流向从原电池负极到原电池正极 | |
| C. | 原电池工作时,电解质溶液中的阴离子向负极移动 | |
| D. | 只要是放热反应就可以将其设计成原电池 |
| A. | 它们的氧化物都能与水反应生成对应的酸 | |
| B. | 碳和硅的最高正价都是+4价 | |
| C. | 硅元素在地壳中的含量占第二位,碳占第一位 | |
| D. | 碳和硅在自然界存在形式都是既有游离态也有化合态 |

| A. | 一定条件下,1 mol A能与3 mol NaOH反应 | |
| B. | 一定条件下,1 mol A能和5 mol氢气发生加成反应 | |
| C. | 一定条件下和浓溴水反应时,1 mol A能消耗3 mol Br2 | |
| D. | A能与碳酸氢钠溶液反应并有气体生成 |