题目内容
2.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中的值$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$减小 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mlpH=11的NaOH溶液,混合液pH=7 |
分析 醋酸是弱电解质,则室温下向10mLpH=3的醋酸溶液中加水稀释后会促进醋酸的电离,溶液中醋酸分子数减小、醋酸根离子、氢离子的数目增大,则溶液中离子的数目增多、$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$的值减小;由于溶液的体积增大,则电离产生的离子的浓度减小,再结合酸碱混合时pH的计算来解答.
解答 解:A.因醋酸溶液中加水稀释,促进电离,则液中导电粒子的数目增多,故A错误;
B.稀释后醋酸的电离程度增大,则溶液中醋酸的分子数减小,醋酸根离子的数目增大,由于在同一溶液中,则$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$的值减小,故B正确;
C.加水稀释时,溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,故C错误;
D、等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,故D错误;
故选B.
点评 本题考查弱电解质电离平衡及其影响,题目难度不大,明确弱电解质的电离平衡及其影响、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化程度是解答本题的关键.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
14.已知H2CO3的酸性比HClO的酸性强,对反应:Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增加可加入( )
| A. | NaOH | B. | HCl | C. | CaCO3(固体) | D. | H2O |
10.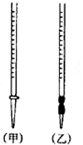 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶、胶头滴管.
(2)滴定:
①盛装0.1000mol•L-1的盐酸标准液应该使用甲(选填“甲”或“乙”).
②将一定体积的待测溶液装在锥形瓶内,若采用甲基橙做指示剂,当观察到由橙色变为黄色,且半分钟内不变色时,滴定达到终点.
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶后未烘干,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低.
(4)有关数据记录如下:
根据以上数据计算,烧碱样品的纯度是80.8%.
 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶、胶头滴管.
(2)滴定:
①盛装0.1000mol•L-1的盐酸标准液应该使用甲(选填“甲”或“乙”).
②将一定体积的待测溶液装在锥形瓶内,若采用甲基橙做指示剂,当观察到由橙色变为黄色,且半分钟内不变色时,滴定达到终点.
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶后未烘干,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低.
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
14.下列有关说法正确的是( )
| A. | 反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| B. | 工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 | |
| C. | 常温下,0.1mol•L-1 CH3COOH溶液pH=1 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小和溶液的pH均增大 |
11.过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源.Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O═4NaOH+O2↑.以下是某兴趣小组进行的探究活动.
(1)利用如下图所示实验装置制取氧气,请回答有关问题.

①实验室制取CO2的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
②表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的氧气密度比空气的大,氧气有助燃性性质.
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进在A、B装置之间增加气体干燥装置
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种.通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
②同学们通过讨论和实验证明了X是Na2CO3.以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整.
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数..
(1)利用如下图所示实验装置制取氧气,请回答有关问题.

①实验室制取CO2的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
②表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的氧气密度比空气的大,氧气有助燃性性质.
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进在A、B装置之间增加气体干燥装置
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种.通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
②同学们通过讨论和实验证明了X是Na2CO3.以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整.
| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |
12.下列离子方程式中,能正确反映醋酸与氧化钠反应的离子方程式( )
| A. | CH3COOH+OH-═CH3COO-+H2O | B. | H++OH-═H2O | ||
| C. | CH3COOH+OH-+Na+═CH3COONa+H2O | D. | CH3COOH+NaOH═CH3COO-+Na++H2O |
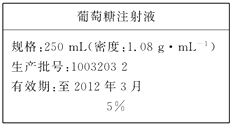 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.