题目内容
12.下列离子方程式中,能正确反映醋酸与氧化钠反应的离子方程式( )| A. | CH3COOH+OH-═CH3COO-+H2O | B. | H++OH-═H2O | ||
| C. | CH3COOH+OH-+Na+═CH3COONa+H2O | D. | CH3COOH+NaOH═CH3COO-+Na++H2O |
分析 二者反应生成醋酸钠和水,醋酸为弱酸,离子方程式中醋酸需要保留分子式;氢氧化钠为强碱,离子方程式中需要拆开,据此书写该反应的离子方程式.
解答 解:醋酸与氢氧化钠反应的化学方程式为:CH3COOH+NaOH═CH3COONa+H2O,醋酸为弱酸,离子方程式中需要保留分子式,二者反应的离子方程式为:CH3COOH+OH-═CH3COO-+H2O,故A正确;
故选A.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
2.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中的值$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$减小 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mlpH=11的NaOH溶液,混合液pH=7 |
3.已知:乙二酸(H2C2O4)是二元弱酸.向10mL 0.1mol•L-1 Na2C2O4溶液中逐滴加入a mL 0.1mol•L-1盐酸(混合前后溶液体积变化可忽略).下列说法正确的是( )
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04 mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
1.下列说法正确的是( )
| A. | Na2CO3是强电解质,BaCO3是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.1 mol•L-1醋酸溶液加水稀释时,电离能力增强,但c(H+)变小 |
18.AgCl和BaSO4的溶解度随温度的变化曲线如图所示.下列说法不正确的是( )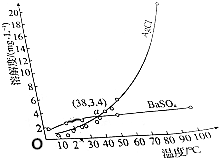

| A. | a点时,AgCl和BaSO4饱和溶液的密度基本相同 | |
| B. | AgCl的溶解是吸热过程 | |
| C. | 室温时,向等体积的饱和AgCl和BaSO4溶液中分别加入足量的浓BaCl2溶液,析出BaSO4沉淀的质量比AgCl多 | |
| D. | 可以用重结晶的方法分离AgCl和BaSO4 |
19.在25℃时,在水中通入氯化氢气体,当溶液的pH等于3时,此时由水本身电离出的c(H+)是(mol•L-1)( )
| A. | 10-3 | B. | 10-7 | C. | 10-11 | D. | 10-14 |

 .
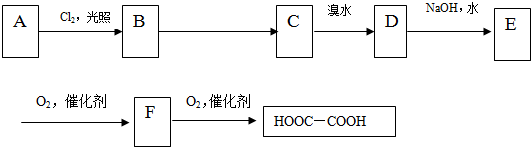
.
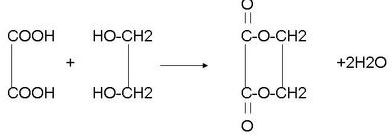 .
.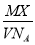 表示的是
表示的是