题目内容
10.下列物质中,不能由金属与非金属直接化合生成的是( )| A. | FeCl2 | B. | FeCl3 | C. | Na2S | D. | Fe3O4 |
分析 氯气具有强氧化性,与变价金属生成高价金属氯化物,S具有弱氧化性,Fe与氧气反应生成四氧化三铁,以此来解答.
解答 解:A.Fe与Cl2反应生成FeCl3,故A选;
B.Fe与Cl2反应生成FeCl3,故B不选;
C.Na与S反应生成Na2S,故C不选;
D.Fe与氧气在点燃条件下反应生成Fe3O4,故D不选;
故选A.
点评 本题考查金属及化合物的性质,为高频考点,把握物质的性质、发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
1.化学版《青花瓷》中所描绘的“蓝色絮状的沉淀跃然试管底 铜离子遇氢氧根 再也不分离”、“无色酚酞面对碱 羞涩脸绯红 紫色石蕊遇到碱 青蓝慢淡出”等现象大家耳熟能详,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |
18.利用如图所示装置进行下列实验,试管②中一定观察不到的现象是( )
| 选项 | a | b | c | 试管②中现象 | 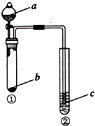 |
| A | NaOH溶液 | Al | 肥皂水 | 肥皂泡可点燃 | |
| B | 稀盐酸 | 碳酸钙 | NaAlO2溶液 | 生成白色絮状沉淀生成 | |
| C | 稀硫酸 | NaHCO3 | BaCl2溶液 | 溶液变浑浊 | |
| D | 水 | Na2O2 | 酸化的FeSO4溶液 | 溶液变黄 |
| A. | A | B. | B | C. | C | D. | D |
5.常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种.已知A、B溶液中水的电离程度相同,A、C溶液的pH相同.下列说法中不正确的是( )
| A. | D溶液的pH=7 | |
| B. | 四种溶液相比,C溶液中水的电离程度最大 | |
| C. | A与C等体积混合后,溶液中有c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| D. | B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+) |
15.在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放.在催化转化器中,CO和NO发生反应:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.该反应的氧化剂是( )
| A. | CO | B. | NO | C. | CO2 | D. | N2 |
2.下列说法正确的是( )
| A. | 已知CH3OH(l)的燃烧热为238.6 kJ•mol-1,则CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-238.6 kJ•mol-1 | |
| B. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| C. | 反应H2+Cl2═2HCl(△H<0)的机理包含①Cl2-→2Cl(慢),②H2+Cl-→HCl+H(快),③Cl2+H-→HCl+Cl(快),则反应①的活化能小于反应②的活化能 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
19. 已知,常温下H2S、H2CO3的电离常数如表
已知,常温下H2S、H2CO3的电离常数如表
(1)①常温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是硫化钠溶液.其原因是硫氢根离子的电离常数小于碳酸氢根离子,则其水解程度大于碳酸根离子.
②常温下,硫化钠水解的离子方程式S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-.
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子.
①常温下,NaHS溶液显碱性(选填“酸性”、“中性”或“碱性”)
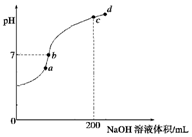
②常温下,向100mL 0.1mol•L-1 H2S溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是c;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-).
③试解释工业上用可溶性铜盐作为沉淀剂除废水中少量NaHS溶液时,废水pH减小的原因Cu2++HS-=H++CuS↓,使得氢离子浓度增大溶液pH减小(写出必要的文字叙述和相关方程式)
(3)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有FeCl2;H2S(填化学式).
(4)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是副产氢气,生成的NaOH可循环利用.
 已知,常温下H2S、H2CO3的电离常数如表
已知,常温下H2S、H2CO3的电离常数如表| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1×10-15 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
②常温下,硫化钠水解的离子方程式S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-.
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子.
①常温下,NaHS溶液显碱性(选填“酸性”、“中性”或“碱性”)
②常温下,向100mL 0.1mol•L-1 H2S溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是c;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-).
③试解释工业上用可溶性铜盐作为沉淀剂除废水中少量NaHS溶液时,废水pH减小的原因Cu2++HS-=H++CuS↓,使得氢离子浓度增大溶液pH减小(写出必要的文字叙述和相关方程式)
(3)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有FeCl2;H2S(填化学式).
(4)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是副产氢气,生成的NaOH可循环利用.
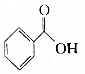
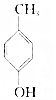
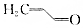 .则与键线式为
.则与键线式为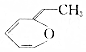 的物质互为同分异构体的是( )
的物质互为同分异构体的是( )