题目内容
11.下列有关物质用途的说法中,不正确的是( )| A. | SO2可用于漂白纸浆 | B. | SiO2是良好的半导体材料 | ||
| C. | Na2O2可用作潜水艇O2来源 | D. | Cl2可用于消毒和制造漂白粉 |
分析 A.二氧化硫具有漂白性;
B.二氧化硅为绝缘体;
C.过氧化钠与水、二氧化碳反应生成氧气;
D.氯气与水反应生成的次氯酸具有杀菌消毒作用,氯气能够与氢氧化钙反应制备漂白粉.
解答 解:A.二氧化硫具有漂白性,可以用来漂白纸浆,故A正确;
B.二氧化硅为绝缘体,硅为良好的半导体材料,故B错误;
C.过氧化钠与水、二氧化碳反应生成氧气,常用作供氧剂,故C正确;
D.氯气与水反应生成的次氯酸具有杀菌消毒作用,氯气能够与氢氧化钙反应制备漂白粉,故D正确;
故选:B.
点评 本题考查了元素化合物知识,侧重考查元素化合物用途,性质决定用途,熟悉相关物质的用途是解题关键,题难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列说法正确的是( )
| A. | 已知CH3OH(l)的燃烧热为238.6 kJ•mol-1,则CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-238.6 kJ•mol-1 | |
| B. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| C. | 反应H2+Cl2═2HCl(△H<0)的机理包含①Cl2-→2Cl(慢),②H2+Cl-→HCl+H(快),③Cl2+H-→HCl+Cl(快),则反应①的活化能小于反应②的活化能 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
19. 已知,常温下H2S、H2CO3的电离常数如表
已知,常温下H2S、H2CO3的电离常数如表
(1)①常温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是硫化钠溶液.其原因是硫氢根离子的电离常数小于碳酸氢根离子,则其水解程度大于碳酸根离子.
②常温下,硫化钠水解的离子方程式S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-.
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子.
①常温下,NaHS溶液显碱性(选填“酸性”、“中性”或“碱性”)
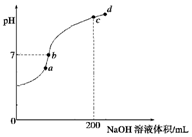
②常温下,向100mL 0.1mol•L-1 H2S溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是c;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-).
③试解释工业上用可溶性铜盐作为沉淀剂除废水中少量NaHS溶液时,废水pH减小的原因Cu2++HS-=H++CuS↓,使得氢离子浓度增大溶液pH减小(写出必要的文字叙述和相关方程式)
(3)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有FeCl2;H2S(填化学式).
(4)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是副产氢气,生成的NaOH可循环利用.
 已知,常温下H2S、H2CO3的电离常数如表
已知,常温下H2S、H2CO3的电离常数如表| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1×10-15 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
②常温下,硫化钠水解的离子方程式S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-.
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子.
①常温下,NaHS溶液显碱性(选填“酸性”、“中性”或“碱性”)
②常温下,向100mL 0.1mol•L-1 H2S溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是c;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(HS-)>c(OH-)=c(H+)>c(S2-).
③试解释工业上用可溶性铜盐作为沉淀剂除废水中少量NaHS溶液时,废水pH减小的原因Cu2++HS-=H++CuS↓,使得氢离子浓度增大溶液pH减小(写出必要的文字叙述和相关方程式)
(3)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有FeCl2;H2S(填化学式).
(4)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)Na2S+2H2O$\frac{\underline{\;通电\;}}{\;}$S↓+H2↑+2NaOH;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是副产氢气,生成的NaOH可循环利用.
16.有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为( )
| A. | 2:1 | B. | 1:1 | C. | 1:2 | D. | 3:2 |
1.下列说法中错误的是( )
| A. | 分类是学习和研究化学物质及其变化的一种常用方法 | |
| B. | 有些液态胶体也是透明的,用肉眼很难与溶液相区别 | |
| C. | 2 L1 mol/L Na2 CO3溶液中c(Na+)为4 mol/L | |
| D. | 从1 LNaCl溶液中取出100 ml,其浓度与原1L溶液相同 |
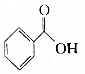
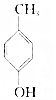
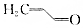 .则与键线式为
.则与键线式为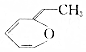 的物质互为同分异构体的是( )
的物质互为同分异构体的是( )