题目内容
7.常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,溶液的pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )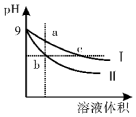
| A. | b、c两点溶液的导电能力b>c | |
| B. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb>Vc | |
| C. | c点溶液中c(H+)=c (OH-)+c(CH3COOH) | |
| D. | a、b、c三点溶液中水的电离程度a>c>b |
分析 NaOH是强电解质,CH3COONa是强碱弱酸盐,加水稀释促进醋酸根离子水解,稀释相同的倍数时,溶液中c(OH-):CH3COONa>NaOH,所以pH变化大的是NaOH,则II为NaOH,变化小的是CH3COONa,即I为CH3COONa,
A.溶液导电能力与离子浓度成正比;
B.pH相等的NaOH和CH3COONa溶液,c(CH3COONa)>c(NaOH),相同体积相同pH的醋酸钠和氢氧化钠溶液消耗相同浓度的盐酸体积与氢氧化钠和醋酸钠的物质的量成正比;
C.任何电解质溶液中都存在质子守恒;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:NaOH是强电解质,CH3COONa是强碱弱酸盐,加水稀释促进醋酸根离子水解,稀释相同的倍数时,溶液中c(OH-):CH3COONa>NaOH,所以pH变化大的是NaOH,则II为NaOH,变化小的是CH3COONa,即I为CH3COONa,
A.溶液的导电能力与离子浓度成正比,pH相等的醋酸钠和氢氧化钠,c(CH3COONa)>c(NaOH),所以c点导电能力大于b,故A错误;
B.pH相等的NaOH和CH3COONa溶液,c(CH3COONa)>c(NaOH),相同体积相同pH的醋酸钠和氢氧化钠溶液消耗相同浓度的盐酸体积与氢氧化钠和醋酸钠的物质的量成正比,相同体积相同pH的醋酸钠和氢氧化钠溶液n(CH3COONa)>n(NaOH),所以醋酸钠消耗盐酸多,消耗盐酸体积Vb<Vc,故B错误;
C.任何电解质溶液中都存在质子守恒,根据质子守恒得C(H+)+C(CH3COOH)=C(OH-),故C错误;
D.氢氧化钠对水的电离起抑制作用,而醋酸根离子浓度越大对水的电离程度越促进程度越大,所以a、b、c三点溶液中水的电离程度a>c>b,故D正确;
故选D.
点评 本题考查盐类水解,为高频考点,侧重考查学生分析判断能力,明确酸碱、含有弱离子的盐对水电离的影响原理是解本题关键,会根据图中曲线变化判断碱和盐,注意电荷守恒、质子守恒的灵活运用,题目难度不大.

| A. | 1L 0.1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 4.6g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子 | |
| C. | 标准状况下,将22.4L Cl2通入水中发生反应,转移的电子数为NA | |
| D. | 100g 46%的乙醇溶液中,含H-O键的数目为NA |
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 7种 |
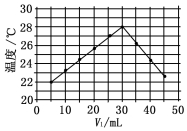 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明可将热能转化为化学能 | |
| C. | NaOH溶液的浓度约为1.5 mol•L-1 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | O3与SO2的结构相似 | |
| D. | P4和CH4都是正四面体分子且键角都为109°28ˊ |
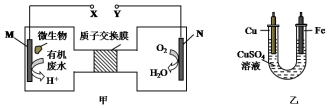
| A. | N为正极,铁电极应与Y相连接 | |
| B. | M电极反应式:CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| C. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g | |
| D. | H十透过质子交换膜由右向左移动 |
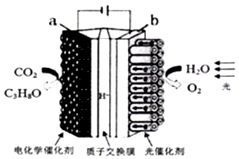 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O | |
| C. | 该装置工作时,H+从b极区向a极区迁移 | |
| D. | 每生成1molO2有44gCO2被还原 |
| A. | 用浓硫酸干燥NH3 | B. | 用乙醇萃取溴水中的溴单质 | ||
| C. | 用品红溶液鉴别SO2和CO2 | D. | 用焰色反应鉴别KCl和KOH |
 氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.
氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.