题目内容
8.下列解释物质检验原理的方程式不合理的是( )| A. | 浓氨水检验泄露的氯气,产生白烟:2NH3+3Cl2═6HCl+N2 | |
| B. | 铁氰化钾检验溶液中Fe2+,产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| C. | 浓溴水检验水体中的苯酚,产生白色沉淀: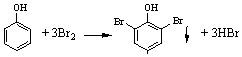 | |
| D. | 新制Cu(OH)2检验产品中乙醛,产生砖红色沉淀:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O |
分析 A.浓氨水检验泄露的氯气,Cl2是氧化剂,NH3是还原剂,生成氮气和氯化氢,氨气过量和生成的氯化氢气体反应,生成氯化铵白色固体颗粒,发出白烟;
B.铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀,为蓝色沉淀;
C.浓溴水滴入苯酚溶液中可以生成2,4,6-三溴苯酚白色沉淀;
D.在碱性条件下,乙醛与新制的Cu(OH)2发生氧化反应生成乙酸钠和氧化亚铜.
解答 解:A.浓氨水检验泄露的氯气,N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,Cl2是氧化剂,NH3是还原剂,反应方程式为:3Cl2+2NH3=N2+6HCl,氨气过量和生成的氯化氢气体反应HCl+NH3=NH4Cl,生成氯化铵白色固体颗粒,发出白烟,总方程式为:3Cl2+8NH3=N2+6NH4Cl,故A错误;
B.铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀,离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,故B正确;
C.浓溴水滴入苯酚溶液中可以生成2,4,6-三溴苯酚白色沉淀,反应的方程式为: ,故C正确;
,故C正确;
D.在氢氧化钠溶液中,乙醛与新制的Cu(OH)2发生氧化反应生成乙酸和氧化亚铜,反应的方程式为:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O,故D正确;
故选A.
点评 本题考查方程式的书写,掌握相关物质的性质是解答关键,注意铁氰化钾检验溶液中Fe2+,为易错点,题目难度中等.

练习册系列答案
相关题目
17.下列方案能达到实验目的是( )
| A. | 用浓硫酸干燥NH3 | B. | 用乙醇萃取溴水中的溴单质 | ||
| C. | 用品红溶液鉴别SO2和CO2 | D. | 用焰色反应鉴别KCl和KOH |
19.下列物质放在空气中变质,且变质过程与空气中的O2、CO2、水蒸气都有关的是( )
| A. | 过氧化钠 | B. | 金属钠 | C. | 硫酸亚铁晶体 | D. | 亚硫酸钠 |
16.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
| A. | 30gC2H6中含有极性共价键的数目为6NA | |
| B. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| C. | 1mol氯气分别与铁和铝完全反应时转移的电子数均为3NA | |
| D. | 25℃,pH=7的NH4Cl和NH3•H2O的混合溶液中,含OH-的数目为10-7NA |
3.化学与生产、生活密切联系.下列说法正确的是( )
| A. | 食品包装中使用生石灰或硅胶可吸收水分使食品保持干燥 | |
| B. | 将化工厂排放废气的烟囱加高可减少烟尘对环境的污染 | |
| C. | 将家用84消毒液与洁厕灵混合使用可提高去污效果 | |
| D. | 向海水中加明矾可使海水淡化 |
13.某化学兴趣小组设计实验探究Mg与盐溶液反应的多样性.
请回答下列问题:
(1)对实验I进行研究:
①推测实验Ⅰ中黑色固体为Ag,则发生反应的离子方程式为2Ag++Mg=2Ag+Mg2+.
②确认黑色固体为Ag的实验方案是将黑色固体过滤、洗涤,向其中加入稀HNO3,黑色固体溶解并产生无色气体,遇空气后变成红棕色,并向所得溶液中滴加NaCl溶液,生成白色沉淀.
(2)对实验II进行研究:
①反应开始时产生H2的原因可能是Mg和NH4+直接反应,或NH4+水解使溶液中c(H+)增大,与Mg反应生成H2.
②“一段时间后”产生的气体一定含有H2和NH3.
③为进一步研究,设计如下实验:
结合实验II、IV,可以得出的结论是Cl-有利于Mg和铵盐溶液反应产生H2(或SO42-不利于Mg和铵盐溶液反应产生H2、溶液中阴离子的种类会影响Mg和铵盐溶液反应产生H2).
(3)对实验III进行研究:
①经检验,白色固体为碱式碳酸镁[Mg2(OH)2CO3].
②推测在pH=8.2的该溶液中,若无HCO3-,则H+和Mg反应的程度很小.通过实验证实了该推测,其实验操作是向装有相同镁条的试管中加入2mLpH=8.2的NaOH溶液.
(4)根据上述实验判断,影响Mg与盐溶液反应多样性的原因有ACD(填字母序号)
A.盐溶液中阳离子的氧化性 B.盐溶液的温度
C.含Mg生成物的溶解性 D.盐溶液中阴离子的影响.
请回答下列问题:
| 实验 | 向试管中加2mL溶液 | 实验现象 |
 | 实验I:0.1 mol/L AgNO3溶液 | 镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡产生 |
| 实验II:2.0 mol/L NH4Cl溶液 | 反应开始时产生大量气体(经检验其中含有H2),一段时间后产生使湿润的红色石蕊试纸变蓝的气体 | |
| 实验III:pH=8.2 NaHCO3溶液 | 产生大量气体(经检验其中含有H2和CO2)和白色固体 |
①推测实验Ⅰ中黑色固体为Ag,则发生反应的离子方程式为2Ag++Mg=2Ag+Mg2+.
②确认黑色固体为Ag的实验方案是将黑色固体过滤、洗涤,向其中加入稀HNO3,黑色固体溶解并产生无色气体,遇空气后变成红棕色,并向所得溶液中滴加NaCl溶液,生成白色沉淀.
(2)对实验II进行研究:
①反应开始时产生H2的原因可能是Mg和NH4+直接反应,或NH4+水解使溶液中c(H+)增大,与Mg反应生成H2.
②“一段时间后”产生的气体一定含有H2和NH3.
③为进一步研究,设计如下实验:
| 实验 | 操作 | 现象 |
| 实验IV | 向装有相同镁条的试管中加入2mL1.0mol/L (NH4)2SO4溶液 | 产生气体的速率明显慢于实验II |
(3)对实验III进行研究:
①经检验,白色固体为碱式碳酸镁[Mg2(OH)2CO3].
②推测在pH=8.2的该溶液中,若无HCO3-,则H+和Mg反应的程度很小.通过实验证实了该推测,其实验操作是向装有相同镁条的试管中加入2mLpH=8.2的NaOH溶液.
(4)根据上述实验判断,影响Mg与盐溶液反应多样性的原因有ACD(填字母序号)
A.盐溶液中阳离子的氧化性 B.盐溶液的温度
C.含Mg生成物的溶解性 D.盐溶液中阴离子的影响.
20.下列关于有机化合物的说法不正确的是( )
| A. | 二甲苯和四甲苯均有三种 | |
| B. | C3H8和C5H12一定互为同系物 | |
| C. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 | |
| D. | 乙醇的酯化反应和酯的水解均属于取代反应 |
17.下列生成 CO2的化学反应中,能用 2H++CO32-→H2O+CO2↑离子方程式表示的是( )
| A. | 稀盐酸与碳酸钙 | B. | 稀硫酸与碳酸氢钠 | ||
| C. | 稀醋酸与碳酸钠 | D. | 稀硝酸与碳酸钾 |