题目内容
10.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体.测出混合气体密度是同温同压下氢气的28倍.再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定).计算混合气体中NO2的体积分数.分析 对氢气的相对密度为28的混合气体,平均分子量为56,浓硝酸与足量的铜反应生成的混合气体是NO2,N2O4,NO,设生成1mol混合气体,三者的物质的量分别为xmol、ymol、zmol,根据物质的量以及平均摩尔质量列式,结合气体通过水后,体积缩小了$\frac{2}{3}$计算xmol,ymol,zmol在相同条件下,体积百分含量等于物质的量分数,据此进行分析.
解答 解:对氢气的相对密度为28的混合气体,平均分子量为56,浓硝酸与足量的铜反应生成的混合气体是NO2,N2O4,NO,设生成1mol混合气体,三者的物质的量分别为xmol、ymol、zmol,故x+y+z=1mol①,平均相对分子质量为56,得46x+92y+30z=56②,气体通过水后,体积缩小了$\frac{2}{3}$,即最后气体体积为$\frac{1}{3}$,N2O4相当于2个NO2,3NO2+H2O=2HNO3+NO,相当于NO2和N2O4与水反应生成NO,3个NO2生成1个NO,即:$\frac{(x+2y)}{3}+z=\frac{1}{3}$,③,联①②③解得:x=$\frac{49}{54}$mol,则混合气体中含NO2的体积百分含量为$\frac{\frac{49}{54}}{1}×100%$=90.7%
答:计算混合气体中NO2的体积分数90.7%.
点评 本题考查氮的化合物的计算,为高频考点,注意隐含条件2NO2?N2O4为解答的关键,侧重考查学生的分析思维能力与解题方法技巧,题目难度中等.

练习册系列答案
相关题目
19.图甲是利用一种微生物将废水中的尿素【CO(NH2)2】的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )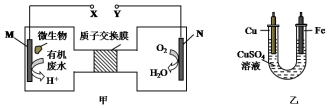

| A. | N为正极,铁电极应与Y相连接 | |
| B. | M电极反应式:CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| C. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g | |
| D. | H十透过质子交换膜由右向左移动 |
20.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | 0.1molCl2与足量石灰乳反应,转移电子的数目为0.2NA | |
| C. | 室温下,l L pH=13的NaOH溶液中,由水电离出的OH-离子数目为0.1NA | |
| D. | 标准状况下,2.24 LNO2和N2O4混合气体中含有氧原子数目为0.2NA |
17.下列方案能达到实验目的是( )
| A. | 用浓硫酸干燥NH3 | B. | 用乙醇萃取溴水中的溴单质 | ||
| C. | 用品红溶液鉴别SO2和CO2 | D. | 用焰色反应鉴别KCl和KOH |
5.建设“碧水蓝天”的生态城市,下列措施中不合理的是( )
| A. | 大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 | |
| B. | 积极推广太阳能、风能等新能源的使用,减少化石燃料的使用 | |
| C. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| D. | 加高烟囱,减少烟尘对周围环境的影响 |
2.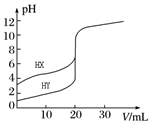 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )| A. | pH=7时,滴定HX消耗NaOH溶液体积等于20.00 mL | |
| B. | 将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH (HX) | |
| C. | 当NaOH溶液体积为20.00 mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-) |
19.下列物质放在空气中变质,且变质过程与空气中的O2、CO2、水蒸气都有关的是( )
| A. | 过氧化钠 | B. | 金属钠 | C. | 硫酸亚铁晶体 | D. | 亚硫酸钠 |
20.下列关于有机化合物的说法不正确的是( )
| A. | 二甲苯和四甲苯均有三种 | |
| B. | C3H8和C5H12一定互为同系物 | |
| C. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 | |
| D. | 乙醇的酯化反应和酯的水解均属于取代反应 |