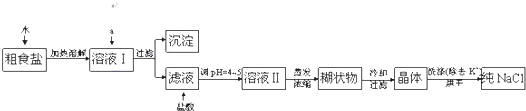
题目内容
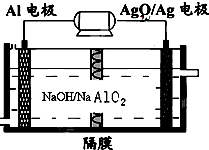 铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )
铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )| A、电池负极反应式2Ag+2OH--2e-=Ag 2O+H2O |
| B、放电时电池负极附近PH减小 |
| C、电池总反应式2Al+3Ag2O+6H+=2Al3++6Ag+3H2O |
| D、电解液中Na+通过隔膜由右向左移动 |
考点:原电池和电解池的工作原理
专题:
分析:由原电池总反应可知,原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,Ag2O被还原,应为原电池的正极,电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,结合电极反应式进行判断.
解答:
解:A.负极上铝失电子和碱反应生成偏铝酸根离子,负极上的电极反应为:Al-3e-+4OH-═AlO2-+2H2O,故A错误;
B.在正极区氢氧根离子浓度增大,则氢离子浓度减小,在负极区氢氧根离子浓度减小,则氢离子浓度增大,故B正确;
C.负极上的电极反应为:Al-3e-+4OH-═AlO2-+2H2O,正极上的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,所以电池反应式为:2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,故C错误;
D.电解液中Na+通过隔膜由左向右移,故D错误;
故选B.
B.在正极区氢氧根离子浓度增大,则氢离子浓度减小,在负极区氢氧根离子浓度减小,则氢离子浓度增大,故B正确;
C.负极上的电极反应为:Al-3e-+4OH-═AlO2-+2H2O,正极上的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,所以电池反应式为:2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,故C错误;
D.电解液中Na+通过隔膜由左向右移,故D错误;
故选B.
点评:本题考查化学电源新型电池,题目难度中等,解答本题的关键是能正确书写电极方程式,做题时注意体会书写方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式中书写正确的是( )
| A、FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- |
| B、Fe和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |
| C、FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ |
| D、用醋酸除水垢 2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:其中a、b、c、d的关系正确的是( )
①1×10-3 mol/L 的氨水b L
②c(OH-)=1×10-3 mol/L 的氨水c L
③pH=11的Ba(OH)2溶液d L.
①1×10-3 mol/L 的氨水b L
②c(OH-)=1×10-3 mol/L 的氨水c L
③pH=11的Ba(OH)2溶液d L.
| A、a=b>c>d |
| B、b>a=d>c |
| C、a=b>d>c |
| D、c>a=d>b |
在反应Fe2(SO4)3+6KSCN?2Fe(SCN)3+3K2SO4达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是( )
| A、KSCN |
| B、K2SO4 |
| C、NaOH |
| D、FeCl3 |
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、X与Y形成化合物时,X可以显负价,Y显正价 |
| B、最高价含氧酸的酸性:X对应的酸性弱于Y对应的 |
| C、第一电离能可能Y小于X |
| D、气态氢化物的稳定性:HmY小于HnX |
下列物质属于盐的是( )
| A、HNO3 |
| B、CuO |
| C、KOH |
| D、NaCl |