题目内容
在反应Fe2(SO4)3+6KSCN?2Fe(SCN)3+3K2SO4达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是( )
| A、KSCN |
| B、K2SO4 |
| C、NaOH |
| D、FeCl3 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:根据实际参加反应的离子浓度分析,平衡为:Fe3++3SCN-?Fe(SCN)3,加入少量K2SO4固体,溶液中Fe3+、SCN-浓度不变.
解答:
解:A、KSCN,SCN-浓度变大,平衡正向移动,故A错误;
B、加入少量K2SO4固体,溶液中Fe3+、SCN-浓度不变,平衡不移动,故B正确;
C、NaOH导致铁离子浓度减小,平衡逆向移动,故C错误;
D、FeCl3导致铁离子浓度增大,平衡正向移动,故D错误;
故选B.
B、加入少量K2SO4固体,溶液中Fe3+、SCN-浓度不变,平衡不移动,故B正确;
C、NaOH导致铁离子浓度减小,平衡逆向移动,故C错误;
D、FeCl3导致铁离子浓度增大,平衡正向移动,故D错误;
故选B.
点评:本题考查学生对平衡移动原理的理解,比较基础,注意平衡状态中根据实际参加反应的离子浓度分析影响平衡的分析判断.

练习册系列答案
相关题目
一定温度下,向2.0L恒容密闭容器中充入1.0mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前2 s 的平均速率v(CO)=0.080mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(Cl2)=0.11 mol?L-1,则正反应为放热反应 |
| C、向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆 |
| D、若起始向容器中充入1.0 mol Cl2 和0.9 mol CO,达到平衡时,Cl2的转化率大于80% |
某溶液中有NH4+、Mg2+、Fe2+ 和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的离子是( )
| A、NH4+、Mg2+ |
| B、Fe2+、Mg2+ |
| C、Fe2+、NH4+ |
| D、Al3+、Fe2+ |
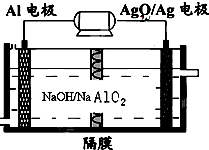 铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )
铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )| A、电池负极反应式2Ag+2OH--2e-=Ag 2O+H2O |
| B、放电时电池负极附近PH减小 |
| C、电池总反应式2Al+3Ag2O+6H+=2Al3++6Ag+3H2O |
| D、电解液中Na+通过隔膜由右向左移动 |
下列叙述正确的是( )
| A、常温下,78 g Na2O2中含有的阴离子数是2NA |
| B、常温下,l L 0.l mol?L-1NH4NO3溶液中含有的NH4+数是0.l NA |
| C、常温常压下,22.4 L SO2和O2混合气体中含有的氧原子数是2 NA |
| D、铁铝混合物与一定量盐酸反应生成1 mol H2时,转移电子数是2 NA |
元素的性质呈现周期性变化的根本原因是( )
| A、原子半径呈周期性变化 |
| B、元素的化合价呈周期性变化 |
| C、第一电离能呈周期性变化 |
| D、元素原子的核外电子排布呈周期性变化 |