题目内容
明矾[KAl(SO4)2?12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等.利用炼铝厂的废料--铝灰(含Al、Al2O3及少量SiO2和FeO?xFe2O3)可制备明矾.工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4-转化为Mn2+) .
已知:生成氢氧化物沉淀的pH如下表所示
注:金属离子的起始浓度为0.1mol?L-1
根据表中数据解释调pH=3的目的 .
(5)己知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.加入MnSO4发生反应的离子方程式为: .滤渣2含有的物质是 .
回答下列问题:

(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是
(3)检验滤液A中是否存在Fe2+的试剂是
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4-转化为Mn2+)
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释调pH=3的目的
(5)己知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.加入MnSO4发生反应的离子方程式为:
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:铝灰(含Al、Al2O3及少量SiO2和FeO?xFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣Ⅰ为二氧化硅和不溶性杂质,滤液A中加入稍过量高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀,铝离子不沉淀,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体和氢氧化铁沉淀,滤液主要是硫酸铝溶液,加入硫酸钾蒸发浓缩,冷却结晶过滤洗涤得到硫酸铝钾晶体;
(1)明矾净水石铝离子水解生成氢氧化铝具有吸附悬浮杂质的作用;
(2)固体和液体分离需要用过滤操作,溶液中得到晶体的方法是蒸发浓缩冷却结晶,过滤洗涤,干燥得到明矾晶体;
(3)检验亚铁离子用高锰酸钾溶液或 铁氰化钾溶液;
(4)酸性溶液中高锰酸钾溶液能氧化亚铁离子为铁离子,本身被还原为锰离子,分析离子沉淀的PH范围调节溶液PH使铁离子全部沉淀,铝离子不沉淀;
(5)在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.加入MnSO4发生反应结合原则守恒和电荷守恒配平书写离子方程式;过滤得到反应中生成难溶的二氧化锰和沉淀得到的氢氧化铁沉淀;
(1)明矾净水石铝离子水解生成氢氧化铝具有吸附悬浮杂质的作用;
(2)固体和液体分离需要用过滤操作,溶液中得到晶体的方法是蒸发浓缩冷却结晶,过滤洗涤,干燥得到明矾晶体;
(3)检验亚铁离子用高锰酸钾溶液或 铁氰化钾溶液;
(4)酸性溶液中高锰酸钾溶液能氧化亚铁离子为铁离子,本身被还原为锰离子,分析离子沉淀的PH范围调节溶液PH使铁离子全部沉淀,铝离子不沉淀;
(5)在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.加入MnSO4发生反应结合原则守恒和电荷守恒配平书写离子方程式;过滤得到反应中生成难溶的二氧化锰和沉淀得到的氢氧化铁沉淀;
解答:
解:铝灰(含Al、Al2O3及少量SiO2和FeO?xFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣Ⅰ为二氧化硅和不溶性杂质,滤液A中加入稍过量高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀,铝离子不沉淀,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体和氢氧化铁沉淀,滤液主要是硫酸铝溶液,加入硫酸钾蒸发浓缩,冷却结晶过滤洗涤得到硫酸铝钾晶体;
(1)明矾净水石铝离子水解生成氢氧化铝具有吸附悬浮杂质的作用,反应的离子方程式为:Al3++3H2O?Al(OH)3+3H+;
故答案为:Al3++3H2O?Al(OH)3+3H+;
(2)固体和液体分离需要用过滤操作,操作Ⅰ是过滤,操作Ⅱ是溶液中得到晶体的方法,利用蒸发浓缩冷却结晶,过滤洗涤,干燥得到明矾晶体;
故答案为:过滤 冷却结晶 洗涤;
(3)检验亚铁离子用高锰酸钾溶液或 铁氰化钾溶液,滴入高锰酸钾溶液紫红色褪去,或加入铁氰化钾溶液会呈现蓝色溶液;
故答案为:高锰酸钾酸性溶液 或 铁氰化钾溶液;
(4)酸性溶液中高锰酸钾溶液能氧化亚铁离子为铁离子,本身被还原为锰离子,反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,分析离子沉淀的PH范围调节溶液PH=3,可以使使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀;
(5)在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.加入MnSO4发生反应,反应的离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2+4H+;过滤得到反应中生成难溶的二氧化锰和沉淀得到的氢氧化铁沉淀;
故答案为:3Mn2++2MnO4-+2H2O=5MnO2+4H+,MnO2、Fe(OH)3;
(1)明矾净水石铝离子水解生成氢氧化铝具有吸附悬浮杂质的作用,反应的离子方程式为:Al3++3H2O?Al(OH)3+3H+;
故答案为:Al3++3H2O?Al(OH)3+3H+;
(2)固体和液体分离需要用过滤操作,操作Ⅰ是过滤,操作Ⅱ是溶液中得到晶体的方法,利用蒸发浓缩冷却结晶,过滤洗涤,干燥得到明矾晶体;
故答案为:过滤 冷却结晶 洗涤;
(3)检验亚铁离子用高锰酸钾溶液或 铁氰化钾溶液,滴入高锰酸钾溶液紫红色褪去,或加入铁氰化钾溶液会呈现蓝色溶液;
故答案为:高锰酸钾酸性溶液 或 铁氰化钾溶液;
(4)酸性溶液中高锰酸钾溶液能氧化亚铁离子为铁离子,本身被还原为锰离子,反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,分析离子沉淀的PH范围调节溶液PH=3,可以使使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀;
(5)在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2.加入MnSO4发生反应,反应的离子方程式为:3Mn2++2MnO4-+2H2O=5MnO2+4H+;过滤得到反应中生成难溶的二氧化锰和沉淀得到的氢氧化铁沉淀;
故答案为:3Mn2++2MnO4-+2H2O=5MnO2+4H+,MnO2、Fe(OH)3;
点评:本题考查了流程分析,反应过程理解应用,反应现象和产物的判断,注意离子检验方法,离子方程式书写式关键,题目难度中等.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
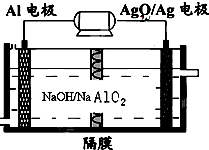 铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )
铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )| A、电池负极反应式2Ag+2OH--2e-=Ag 2O+H2O |
| B、放电时电池负极附近PH减小 |
| C、电池总反应式2Al+3Ag2O+6H+=2Al3++6Ag+3H2O |
| D、电解液中Na+通过隔膜由右向左移动 |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A、若周期表中第七周期完全排满共有32种元素 |
| B、周期表中共有18个列,其中形成化合物种类最多的在第14列 |
| C、除过渡元素外周期表中最外层电子数相同的元素都位于同一族中 |
| D、L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
下列叙述正确的是( )
| A、常温下,78 g Na2O2中含有的阴离子数是2NA |
| B、常温下,l L 0.l mol?L-1NH4NO3溶液中含有的NH4+数是0.l NA |
| C、常温常压下,22.4 L SO2和O2混合气体中含有的氧原子数是2 NA |
| D、铁铝混合物与一定量盐酸反应生成1 mol H2时,转移电子数是2 NA |
下列有关化学用语表示正确的是( )
| A、蚁醛的最简式:CH2O | ||
B、中子数为20的氯原子:
| ||
C、氮原子最外层电子轨道表示式 | ||
D、NH4Br的电子式 |
据科学家预测,月球的土壤中吸附着数百万吨的 3He,每百吨 3He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以 4He的形式存在.下列说法中正确的是( )
| A、4He原子核内含有4个质子 |
| B、3He和4He互为同位素 |
| C、3He原子核内含有3个中子 |
| D、4He的最外层电子数为2,故 4He具有较强的金属性 |
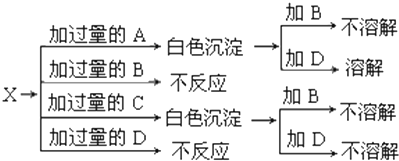 如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.
如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.