题目内容
8.图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: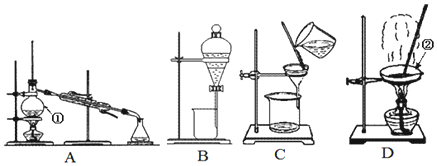
(1)装置A中仪器①的名称是蒸馏烧瓶,装置D中仪器②的名称是蒸发皿
(2)从氯化钾溶液中得到氯化钾固体,应选择装置D (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置A;从碘水中分离出I2,选择装置B,该装置的主要仪器名称是分液漏斗.分离饱和食盐水与沙子的混合物,应选择C装置,分离四氯化碳(沸点为76.75℃)和甲苯(110.6℃)的混合物,应选择装置A.
分析 (1)由装置中仪器的图形可判断;
(2)KCl为可溶性固体,选择蒸发分离;除去自来水中的Cl-等杂质,蒸馏分离;碘不易溶于水,易溶于有机溶剂,萃取、分液分离;沙子不溶于水,可过滤,沸点不同的液体混合物,可蒸馏分离.
解答 解:(1)装置A中仪器①的名称是蒸馏烧瓶,装置D中仪器②的名称是蒸发皿,故答案为:蒸馏烧瓶;蒸发皿;
(2)KCl为可溶性固体,选择蒸发分离,选择装置为D;除去自来水中的Cl-等杂质,蒸馏分离,选择装置为A;碘不易溶于水,易溶于有机溶剂,萃取、分液分离,选择装置为B,主要仪器为分液漏斗,沙子不溶于水,可过滤,用C装置;沸点不同的液体混合物,可蒸馏分离,用A装置,
故答案为:D;A;B;分液漏斗;C;A.
点评 本题考查混合物分离提纯,为高频考点,把握仪器的作用、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 强碱性溶液中可能大量存在Na+、K+、Cl?、CO32? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
19.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Y原子P能级上有2个未成对电子,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | X、Y、Z的电负性大小顺序是Z<Y<X | |
| B. | WY2分子中σ键与π键的数目之比是2:1 | |
| C. | W、X、Y、Z的原子半径大小顺序是X>Y>Z>W | |
| D. | W、Z形成的分子的空间构型是三角锥形 |
16.下列反应是氧化还原反应的是( )
| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | NaCl+AgNO3=AgCl↓+NaNO3 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | CaO+H2O=Ca(OH)2 |
3.物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
| A. | Ba(OH)2、Na2SO3、FeCl3、KCl | B. | Na2SiO3、Na2CO3、KNO3、NH4Cl | ||
| C. | NH3•H2O、H3PO4、Na2SO4、H2SO4 | D. | NaHCO3、C6H5COOH、C2H5OH、HCl |
13.下列溶液可用无色试剂瓶装的是( )
| A. | 浓HNO3 | B. | AgNO3 | C. | 氯水 | D. | 浓H2SO4 |
20.恒温恒容条件下,能使A(g)+B(g)?C(g)+D(s) 正反应速率加快的是( )
| A. | 减少C或D的物质的量 | B. | 体积不变充入氦气 | ||
| C. | 减少B的物质的量 | D. | 增大A或B的物质的量 |
17.下列说法正确的是( )
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 除去KNO3中混杂的NaCl,可用重结晶的方法,是因为氯化钠在水中溶解度大 | |
| C. | 用量筒量取20mL 0.5 mol•L-1H2SO4于烧杯中,加水80mL,配制成0.1 mol•L-1H2SO4溶液 | |
| D. | 将足量的Na2O、Na2O2分别加入到酚酞溶液中,最终溶液均为红色 |
3.设 NA 为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,44g CO2中含有2NA个π键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 0.5mol Cu和足量浓硝酸反应可以生成22.4LNO2 | |
| D. | 过量的液溴与铁反应,若反应中消耗1mol铁,则转移的电子数目为2NA个 |