题目内容
13.下列溶液可用无色试剂瓶装的是( )| A. | 浓HNO3 | B. | AgNO3 | C. | 氯水 | D. | 浓H2SO4 |
分析 见光易分解的物质用棕色瓶盛装,不分解的可用无色瓶装.据此分析.
解答 解:A.浓硝酸易分解,储存在棕色试剂瓶中,故A错误;
B.硝酸银见光易分解,储存在棕色试剂瓶中,故B错误;
C.氯水中的次氯酸见光易分解,储存在棕色试剂瓶中,故C错误;
D.浓硫酸具有吸水性只要求密封保存不能敞口放置,故不用保存在棕色试剂瓶中,故D正确.
故选D.
点评 本题考查试剂的存放,明确物质的性质与保存方法的关系是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
15.已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系.下列说法错误的是( )
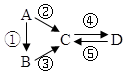

| A. | 若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染.则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO | |
| B. | 若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化.在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H1、△H 2、△H 3,则它们之间的关系为△H 2=△H1+△H 3 | |
| C. | 若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑ | |
| D. | 若A是应用最广泛的金属.④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸 |
4.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在0.2 mol•L-1的Na2CO3溶液中含有Na+的数目为0.4NA | |
| B. | 0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3 NA | |
| C. | 15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA | |
| D. | 标准状况下22.4 L CH4和C2H4的混合气体所含氢原子数为4NA |
1.在化学学科中经常使用下列物理量,其中跟阿佛加德罗常数(NA)无关的组合是:( )
①相对原子质量(Mr) ②摩尔质量(M) ③原子半径(r) ④键能(E) ⑤物质的量(n) ⑥化学反应速率(v) ⑦气体摩尔体积(Vm) ⑧溶解度(S) ⑨燃烧热(△H) ⑩溶质的质量分数(w)
①相对原子质量(Mr) ②摩尔质量(M) ③原子半径(r) ④键能(E) ⑤物质的量(n) ⑥化学反应速率(v) ⑦气体摩尔体积(Vm) ⑧溶解度(S) ⑨燃烧热(△H) ⑩溶质的质量分数(w)
| A. | ①③⑧⑩ | B. | ②④⑤⑥⑦⑨ | C. | ①②③④⑤ | D. | ⑥⑦⑧⑨⑩ |
18.1mol/L的Na2SO4溶液是( )
| A. | 溶液中含有1mol Na2SO4 | |
| B. | 1L水中加入142g Na2SO4 | |
| C. | 1mol Na2SO4溶于1mol水中 | |
| D. | 将1mol Na2SO4溶于水后配成1L溶液 |
5.下列说法正确的是( )
| A. | 烧瓶、锥形瓶、蒸发皿加热时均需要垫上石棉网 | |
| B. | 分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水 | |
| C. | 配制1 mol•L-1NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒 | |
| D. | 量取25.00ml某盐酸,可以用量筒或者酸式滴定管 |
2.下列对物质的分类正确的是( )
| A. | 纯碱、烧碱、熟石灰、碱式碳酸铜都是碱 | |
| B. | 牛奶、豆浆、鸡蛋清溶液、食醋均为胶体 | |
| C. | H2SO4、NaOH、NaNO3、Na2O都是电解质 | |
| D. | 风化、钝化、皂化、焰色反应都是化学变化 |