题目内容
11.9.03×1023个氨分子含1.5摩尔氨分子,标准状况下体积为33.6L,含有15摩尔质子.分析 根据n=$\frac{N}{{N}_{A}}$计算出9.03×1023个氨分子的物质的量,再根据V=nVm计算出标准状况下该氨气的体积;氨气分子中含有10个质子,结合氨气的物质的量计算出含有的质子数.
解答 解:9.03×1023个氨分子的物质的量为:$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1.5mol,
标准状况下1.5mol氨气分子的体积为:22.4L/mol×1.5mol=33.6L,
1.5mol氨气分子中含有质子的物质的量为:1.5mol×10=15mol,
故答案为:1.5;33.6L;15.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、气体摩尔体积之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
2.对于Fe-Cu-稀H2SO4组成的原电池中当有4mol电子通过导线时,则下列说法正确的是( )
| A. | 铁片溶解了56g | B. | 铜片上析出标准状况下22.4L气体 | ||
| C. | 电解质溶液的pH逐渐减小 | D. | SO42-移向Fe电极 |
19.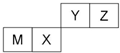 四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
 四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )| A. | 离子半径Z<M<X | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的强 | |
| C. | X 的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
6.高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:

以下说法不合理的是( )

以下说法不合理的是( )
| A. | “除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+.发生的主要反应的离子方程式为2Fe2++H2O2+4NH3•H2O═2Fe(OH)3↓+4NH4+ | |
| B. | 配制硫酸铝溶液时,需用硫酸酸化的目的是抑制Al3+水解 | |
| C. | “结晶”这步操作中,母液需要蒸干后才能获得铵明矾晶体(含结晶水) | |
| D. | “分离”操作的名称是过滤 |
16.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
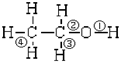

| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和④断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
3.蘸有浓硫酸的纸片会发黑,主要是浓硫酸具有( )
| A. | 吸水性 | B. | 氧化性 | C. | 脱水性 | D. | 酸性 |
20.下列物质中,只含有非极性共价键的是( )
| A. | Na2O2 | B. | I2 | C. | CaCl2 | D. | NaOH |
1.已知A、B、C、D、E是5种短周期元素,C、D、E是原子序数依次递增的同周期元素,A的最外层电子数是其电子层数的3倍,B是组成有机物的必要元素,元素D与B为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 简单离子半径:E>A>C | |
| B. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| C. | C与A形成的两种化合物中化学键类型完全相同 | |
| D. | B、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
 用电极a(铁丝)、电极b(铜丝)和H2SO4溶液可以构成原电池或电解池,如图所示.
用电极a(铁丝)、电极b(铜丝)和H2SO4溶液可以构成原电池或电解池,如图所示.