题目内容
19.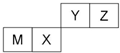 四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )| A. | 离子半径Z<M<X | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的强 | |
| C. | X 的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
分析 四种短周期元素只有M为金属元素,由元素在周期表中的位置,可知M为Al、X为Si、Y为N、Z为O;
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.非金属性越强,最高价氧化物对应水化物的酸性越强;
C.非金属性越强,氢化物越稳定;
D.X为Si,属于原子晶体,熔点最高,常温下Al为固体,在空气中加热时发生熔化,熔点低于晶体硅,而Y的单质为气体.
解答 解:四种短周期元素只有M为金属元素,由元素在周期表中的位置,可知M为Al、X为Si、Y为N、Z为O,
A.N3-、O2-、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径大小为:N3->O2->Al3+,即Z>M>X,故A错误;
B.非金属性N>Si,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性大小为:硝酸>硅酸,故B正确;
C.氢化物稳定性与元素非金属性一致,Z的非金属性比X的强,故Z的氢化物更稳定,故C错误;
D.X为Si,属于原子晶体,熔点最高,常温下Al为固体,在空气中加热时发生熔化,熔点低于晶体硅,而Y的单质为气体,Al的熔点高于氮气,故熔点:X>M>Y,故D错误,
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期表结构为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.

练习册系列答案
相关题目
9.无论在酸性还是在碱性溶液中,可以大量共存的无色离子组是( )
| A. | Na+、K+、HCO3-、Cl- | B. | Cu2+、Mg2+、SO42-、Cl- | ||
| C. | CH3COO-、Cl-、NO3-、K+ | D. | NO3-、Na+、Cl-、Ba2+ |
7.汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一.在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染.反应过程为①2NO2-→2NO+2O,②2NO+O2-→2NO2,③O+O2-→O3.下列对该反应过程及生成物叙述正确的是( )
| A. | NO2起催化剂作用 | B. | NO起催化剂作用 | ||
| C. | NO2只起氧化剂作用 | D. | O3与O2为同位素 |
14.如图是实验室制取氨气的装置和选用的试剂,其中错误的是( )


| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
4. 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )| A. | Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)+c(CH3COOH)=0.1mol•L-1+c(OH-) | |
| C. | 向X点所表示的溶液中加入等体积的0.05mol•L-1 NaOH溶液:c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 该温度下醋酸的电离平衡常数为10-1 mol•L-1 |
8.下列物质中最难电离出H+的是( )
| A. | CH3COOH | B. | C2H5OH | C. | H2O | D. | HCl |
9.对反应方程式:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,有关叙述正确的是( )
| A. | 反应中SiO2是氧化剂,C只作还原剂 | |
| B. | Si4+被还原了,而C只被氧化了 | |
| C. | 在反应中C既是氧化剂又是还原剂 | |
| D. | 在反应中氧化剂与还原剂的物质的量之比为2:1 |