题目内容
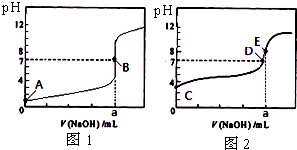 常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )| A、滴定醋酸的曲线是图1 |
| B、达到B、E状态时,两溶液中离子浓度均为c(Na+)=C(A-) |
| C、达到B、D状态时,反应消耗的n(CH3COOH)<n(HCl) |
| D、当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-)>c(Na+)>c(H+)>c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A、根据盐酸和醋酸在滴定开始时的pH来判断;
B、根据酸和碱反应的化学方程式来计算回答;
C、根据溶液中的电荷守恒来判断;
D、根据氢氧化钠和醋酸以及盐酸反应的原理来回答.
B、根据酸和碱反应的化学方程式来计算回答;
C、根据溶液中的电荷守恒来判断;
D、根据氢氧化钠和醋酸以及盐酸反应的原理来回答.
解答:
解:A、滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,故A错误;
B、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的n(CH3COOH)=n(HCl),故B错误;
C、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A-),故C正确;
D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误.
故选C.
B、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的n(CH3COOH)=n(HCl),故B错误;
C、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A-),故C正确;
D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误.
故选C.
点评:本题考查NaOH与CH3COOH、盐酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用电荷守恒的角度做题,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一定条件下,可逆反应N2+3H2?2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
| A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等 |
| B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆增大的倍数 |
| C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆减小的倍数 |
| D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转换率减小,H2转化率增大 |
在稀硫酸中加入铜粉,铜粉不溶解,再加入下列物质①FeCl3②Fe2O3③KNO3④H2O2铜粉能溶解的是( )
| A、只有①、② |
| B、只有①、②、④ |
| C、只有①、③、④ |
| D、上述任一一种 |
有关SO2说法错误的是( )
| A、单质硫在空气中燃烧可生成SO2 |
| B、SO2能使品红溶液褪色是因为它具漂白性,加热可恢复原本红色 |
| C、SO2和Cl2都具有漂白作用,所以将两种气体等物质的量同时作用于潮湿有色物,可增强漂白作用 |
| D、SO2能使加酚酞的NaOH溶液褪色是因为它能与NaOH反应 |
在一定条件下,RO-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A、元素R位于周期表中第ⅤA族 |
| B、RO3-中的R只能被还原 |
| C、R2在常温常压下一定是气体 |
| D、若1 mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
某100m L溶液中含H2SO4 0.5 0mol,加入下列物质,溶液导电性增强的是( )
| A、0.5 0mo1 NaOH |
| B、100 mL水 |
| C、0.50mo1酒精 |
| D、0.50 mol Na2SO4 |

 在一定条件下,二氧化硫和氧气发生如下反应:
在一定条件下,二氧化硫和氧气发生如下反应: 原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据:
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据: