题目内容
在一定条件下,RO-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A、元素R位于周期表中第ⅤA族 |
| B、RO3-中的R只能被还原 |
| C、R2在常温常压下一定是气体 |
| D、若1 mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
考点:氧化还原反应
专题:
分析:A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价.
B、RO3-中R为+5价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性.
C、若R为I或Br也可以发生如上反应.
D、反应中R元素化合价由+5价降低为0,据此计算.
B、RO3-中R为+5价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性.
C、若R为I或Br也可以发生如上反应.
D、反应中R元素化合价由+5价降低为0,据此计算.
解答:
解:A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价,元素R应位于第ⅦA族,故A错误;
B、RO3-中R为+5价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性,故B错误;
C、若R为Cl,单质为气体,若R为I或Br也可以发生如上反应,碘为固体,溴为液体,故C错误;
D、反应中R元素化合价由+5价降低为0,若1molRO3-参与该反应,则转移的电子的物质的量为1mol×(5-0)=5mol,故D正确.
故选:D.
B、RO3-中R为+5价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性,故B错误;
C、若R为Cl,单质为气体,若R为I或Br也可以发生如上反应,碘为固体,溴为液体,故C错误;
D、反应中R元素化合价由+5价降低为0,若1molRO3-参与该反应,则转移的电子的物质的量为1mol×(5-0)=5mol,故D正确.
故选:D.
点评:本题考查学生氧化还原反应、元素性质与物质关系以及根据信息提取知识的能力等,难度中等,关键根据离子方程式判断R的最低负价为-1,最高正价为+7价.是对所学知识的综合运用与能力考查,是一道不错的能力考查题目.

练习册系列答案
相关题目
下列事实不能用勒夏特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
| C、反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
| D、对于2NO2(g)?N2O4(g),达平衡后,缩小容器体积可使体系颜色变深 |
质谱图表明某有机物的相对分子质量为70,红外光谱表征到C=C和C=O的存在,核磁共振谱如图(峰面积之比依次为1:1:1:3),下列说法正确的是( )


| A、分子中共有5种化学环境不同的氢原子 |
| B、该有机物的结构简式为CH3CH=CHCOOH |
| C、该物质的分子式为C4H6O |
| D、该有机物不可能发生银镜反应 |
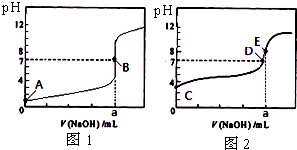 常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )| A、滴定醋酸的曲线是图1 |
| B、达到B、E状态时,两溶液中离子浓度均为c(Na+)=C(A-) |
| C、达到B、D状态时,反应消耗的n(CH3COOH)<n(HCl) |
| D、当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-)>c(Na+)>c(H+)>c(OH-) |
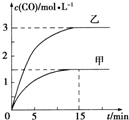 T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )
T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )| 容器 | 甲 | 乙 |
| 容积 | 0.5L | V |
| 2molC 1molH2O | 4molC 2molH2O |
| A、甲容器中前15min反应的平均速率υ(H2)=0.2 mol?L-1?min-1 |
| B、乙容器的容积V=0.5 L |
| C、向甲容器加入少量C(s),平衡正向移动 |
| D、反应温度升高,平衡常数增大 |
下列分子中,既含有σ键,又含有π键的是( )
| A、CH2═CH2 |
| B、HCl |
| C、CH4 |
| D、F2 |
门捷列夫在绘制元素周期表时许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素(与硅处于同族),后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X性质的描述中错误的是( )
| A、X单质不易与水反应 |
| B、XO2可被碳还原为X |
| C、XH4的稳定性比SiH4的高 |
| D、X的半径比Si的大 |
下列化学用语表达正确的是( )
| A、乙酸的结构简式:C2H4O2 |
B、氢氧化钠的电子式: |
C、Cl离子的结构示意图: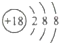 |
| D、NaClO的电离方程式:NaClO=Na++Cl-+O2- |
温度不变恒容的容器中进行反应A?B,若反应物浓度由0.1mol?L-1降到0.06mol?L-1需20s,那么由0.06mol?L-1降到0.036mol?L-1所需反应时间应为( )
| A、等于10s |
| B、等于12s |
| C、大于12s |
| D、小于12s |