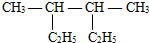题目内容
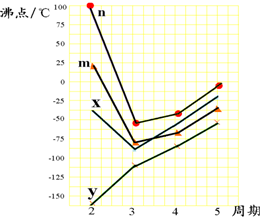 原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据:
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满.下表是主要化合价及原子半径数据:| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径 | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
(2)F2+与NH3形成配离子时提供空轨道的为
(3)图中四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出字母C所对应元素的氢化物所在的折线
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据图表知,-1价的A、D元素处于第VIIA,且B原子序数小于D,所以A是F元素,D是Cl元素,A、B、C、D是短周期非金属元素,B、C、D同周期,-3、+5价的B元素处于第VA族且为第三周期,所以B是P元素,则C是S元素;E、F是第四周期的金属元素,F+的三个能层电子全充满,则F原子核外有29个电子,所以F是Cu元素,+2价的E属于第IIA、第四周期元素,所以E是Ca元素.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能;
(2)溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物;
(3)硫处于第VIA元素,根据第二周期元素氢化物的沸点结合状态判断.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能;
(2)溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物;
(3)硫处于第VIA元素,根据第二周期元素氢化物的沸点结合状态判断.
解答:
解:根据图表知,-1价的A、D元素处于第VIIA,且B原子序数小于D,所以A是F元素,D是Cl元素,A、B、C、D是短周期非金属元素,B、C、D同周期,-3、+5价的B元素处于第VA族且为第三周期,所以B是P元素,则C是S元素;E、F是第四周期的金属元素,F+的三个能层电子全充满,则F原子核外有29个电子,所以F是Cu元素,+2价的E属于第IIA、第四周期元素,所以E是Ca元素.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能,所以B、C、D三种元素第一电离能数值由小到大的顺序是S<P<Cl,
故答案为:S<P<Cl;
(2)铜离子和氨分子形成配离子时提供空轨道的为Cu2+,溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物,反应方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu2+;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(3)C是S元素,处于ⅥA族,在ⅣA族、ⅤA族、ⅥA族、ⅦA族元素,第二周期元素形成的氢化物中,H2O通常为液体,沸点最高,故折线n表示第ⅥA族元素氢化物的沸点变化,故H2S所在的折线为n,
故答案为:n.
(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第VIA族元素小于第VA族元素的第一电离能,所以B、C、D三种元素第一电离能数值由小到大的顺序是S<P<Cl,
故答案为:S<P<Cl;
(2)铜离子和氨分子形成配离子时提供空轨道的为Cu2+,溶液显蓝色说明含有铜离子,铜离子和氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和氨水反应生成铜氨络合物,反应方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu2+;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(3)C是S元素,处于ⅥA族,在ⅣA族、ⅤA族、ⅥA族、ⅦA族元素,第二周期元素形成的氢化物中,H2O通常为液体,沸点最高,故折线n表示第ⅥA族元素氢化物的沸点变化,故H2S所在的折线为n,
故答案为:n.
点评:本题考查元素的位置结构性质关系及应用,题目难度中等,本题从化合价角度来判断元素的种类,正确判断元素是解本题的关键,第一电离能、氢键对物质沸点的影响是高考的热点,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
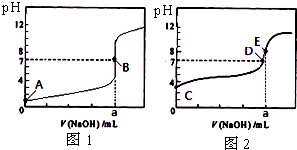 常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )| A、滴定醋酸的曲线是图1 |
| B、达到B、E状态时,两溶液中离子浓度均为c(Na+)=C(A-) |
| C、达到B、D状态时,反应消耗的n(CH3COOH)<n(HCl) |
| D、当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-)>c(Na+)>c(H+)>c(OH-) |
下列分子中,既含有σ键,又含有π键的是( )
| A、CH2═CH2 |
| B、HCl |
| C、CH4 |
| D、F2 |
门捷列夫在绘制元素周期表时许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素(与硅处于同族),后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X性质的描述中错误的是( )
| A、X单质不易与水反应 |
| B、XO2可被碳还原为X |
| C、XH4的稳定性比SiH4的高 |
| D、X的半径比Si的大 |
 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/molNa2O2(s)+CO2(g)=Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为566kJ/mol |
| B、如图所示可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1024(个) |
下列化学用语表达正确的是( )
| A、乙酸的结构简式:C2H4O2 |
B、氢氧化钠的电子式: |
C、Cl离子的结构示意图: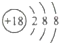 |
| D、NaClO的电离方程式:NaClO=Na++Cl-+O2- |
下列关系正确的是( )
| A、密度:CCl4>CHCl3>H2O>苯 |
| B、沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 |
| C、含氢量:甲烷>乙烯>乙炔>苯 |
| D、同物质的量物质燃烧耗O2量:环己烷>己烷>苯>苯甲酸 |
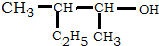 的名称
的名称