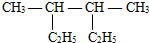题目内容
某100m L溶液中含H2SO4 0.5 0mol,加入下列物质,溶液导电性增强的是( )
| A、0.5 0mo1 NaOH |
| B、100 mL水 |
| C、0.50mo1酒精 |
| D、0.50 mol Na2SO4 |
考点:电解质溶液的导电性
专题:离子反应专题
分析:溶液导电性和离子浓度大小有关
A、生成硫酸钠和水,硫酸过量,溶液中离子浓度变化不大;
B、硫酸的浓度降低了,减弱;
C、酒精是不能导电,影响了硫酸的电离,减弱;
D、增加了电解质增强.
A、生成硫酸钠和水,硫酸过量,溶液中离子浓度变化不大;
B、硫酸的浓度降低了,减弱;
C、酒精是不能导电,影响了硫酸的电离,减弱;
D、增加了电解质增强.
解答:
解:A、与H 2 SO 4 完全反应,硫酸剩余,H 2 SO 4+2NaOH=Na2SO 4+2H 2 O,溶液中反应前和反应后都是强电解质溶液,离子浓度变化不大,故A错误;
B、溶液的体积扩大为原来的2倍,c(H+ )和c(SO42-),都变为原来的一半,溶液的导电性减弱,故B错误;
C、酒精是非电解质,溶解在水中,扩大了溶液的体积,降低了H+、SO42-的浓度,溶液导电性减弱,故C错误;
D、增加了离子的总浓度,溶液的导电性增强,故D正确;
故选D.
B、溶液的体积扩大为原来的2倍,c(H+ )和c(SO42-),都变为原来的一半,溶液的导电性减弱,故B错误;
C、酒精是非电解质,溶解在水中,扩大了溶液的体积,降低了H+、SO42-的浓度,溶液导电性减弱,故C错误;
D、增加了离子的总浓度,溶液的导电性增强,故D正确;
故选D.
点评:本题考查了溶液导电性的分析判断,注意反应混合后溶液中离子浓度的变化分析,掌握基础是关键,题目较简单.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
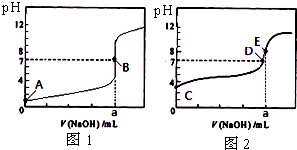 常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )| A、滴定醋酸的曲线是图1 |
| B、达到B、E状态时,两溶液中离子浓度均为c(Na+)=C(A-) |
| C、达到B、D状态时,反应消耗的n(CH3COOH)<n(HCl) |
| D、当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-)>c(Na+)>c(H+)>c(OH-) |
下列化学用语表达正确的是( )
| A、乙酸的结构简式:C2H4O2 |
B、氢氧化钠的电子式: |
C、Cl离子的结构示意图: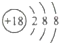 |
| D、NaClO的电离方程式:NaClO=Na++Cl-+O2- |
下列有关溶液组成的描述合理的是( )
| A、在Fe2(SO4)3溶液中可以大量存在:K+、Fe2+、Cl-、Br-、SCN- | ||
| B、c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、HCO3-、NO3- | ||
C、加水稀释时
| ||
| D、在碱性溶液中可以大量存在:S2O32-、AlO2-、SiO32-、S2-、Na+ |
温度不变恒容的容器中进行反应A?B,若反应物浓度由0.1mol?L-1降到0.06mol?L-1需20s,那么由0.06mol?L-1降到0.036mol?L-1所需反应时间应为( )
| A、等于10s |
| B、等于12s |
| C、大于12s |
| D、小于12s |
下列关系正确的是( )
| A、密度:CCl4>CHCl3>H2O>苯 |
| B、沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 |
| C、含氢量:甲烷>乙烯>乙炔>苯 |
| D、同物质的量物质燃烧耗O2量:环己烷>己烷>苯>苯甲酸 |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍.下列说法不正确的是( )
| A、原子半径:Z>W>R |
| B、对应的氢化物的热稳定性:R>W |
| C、W离子的还原性强于R离子 |
| D、W与X、W与Z形成的化合物的化学键类型完全相同 |