题目内容
一定条件下,可逆反应N2+3H2?2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
| A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等 |
| B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆增大的倍数 |
| C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆减小的倍数 |
| D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转换率减小,H2转化率增大 |
考点:化学反应速率的影响因素,化学平衡的影响因素
专题:
分析:A.催化剂同等程度改变化学反应速率,不影响化学平衡;
B.增大压强,正、逆反应速率都增大,平衡向体积减小的方向移动;
C.降低温度,正、逆反应速率都减小,平衡向放热反应方向移动;
D.增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变.
B.增大压强,正、逆反应速率都增大,平衡向体积减小的方向移动;
C.降低温度,正、逆反应速率都减小,平衡向放热反应方向移动;
D.增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变.
解答:
解:A.催化剂同等程度改变化学反应速率,仍保持V正=V逆,化学平衡不发生移动,故A正确;
B.增大压强,正、逆反应速率都增大,平衡向正反应方向移动,V正增大倍数大于V逆增大倍数,故B正确;
C.降低温度,正、逆反应速率都减小,正反应放热,平衡向放热反应方向进行,V正减小倍数小于V逆减小倍数,故C错误;
D.增大氮气的浓度,正逆反应速率都增大,平衡正向移动,所以正反应速率大于逆反应速率,氮气转化率降低,氢气转化率增大,故D正确.
故选C.
B.增大压强,正、逆反应速率都增大,平衡向正反应方向移动,V正增大倍数大于V逆增大倍数,故B正确;
C.降低温度,正、逆反应速率都减小,正反应放热,平衡向放热反应方向进行,V正减小倍数小于V逆减小倍数,故C错误;
D.增大氮气的浓度,正逆反应速率都增大,平衡正向移动,所以正反应速率大于逆反应速率,氮气转化率降低,氢气转化率增大,故D正确.
故选C.
点评:本题考查化学平衡的影响因素,难度中等,D选项注意根据改变条件的瞬间浓度变化判断反应速率变化.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
短周期主族元素A、B、C、D,原子序数依次增大.A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述不正确的是( )
| A、原子半径:B>C>D>A |
| B、单质B制作的容器可用来盛放浓硝酸 |
| C、A、C形成的物质属于两性氧化物 |
| D、元素D在周期表中位于第三周期、VIIA族 |
某混合物水溶液中可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、CO32-、SO42-,现每次取100mL溶液分别进行下列实验:下列说法正确的是( )
| 实验编号 | 实验步骤 | 实验现象 |
| ① | 加入AgNO3溶液 | 有沉淀产生 |
| ② | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ③ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
| A、一定不存在的离子:Ca2+、Cl- |
| B、c(K+)=0.2 mol/L |
| C、c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
| D、一定存在的离子:K+、NH4+、CO32-、SO42- |
2X+Y?2Z(气)△H<0,温度升高,气体平均相对分子质量减小,说法正确的是( )
| A、X和Y可能都是固体 |
| B、X和Y一定都是气体 |
| C、若Y为固体,X一定是气体 |
| D、X和Y不可能都是气体 |
下列离子方程式正确的是( )
| A、Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | ||||
| B、双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | ||||
C、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ |
下列事实不能用勒夏特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
| C、反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
| D、对于2NO2(g)?N2O4(g),达平衡后,缩小容器体积可使体系颜色变深 |
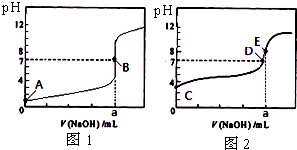 常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )| A、滴定醋酸的曲线是图1 |
| B、达到B、E状态时,两溶液中离子浓度均为c(Na+)=C(A-) |
| C、达到B、D状态时,反应消耗的n(CH3COOH)<n(HCl) |
| D、当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-)>c(Na+)>c(H+)>c(OH-) |
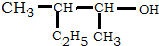 的名称
的名称