题目内容
16.下列离子反应方程式书写正确的是( )| A. | HClO与NaOH溶液反应 H++OH-═H2O | |
| B. | CaCO3与稀盐酸反应 CO32-+2H+═CO2↑+H2O | |
| C. | Fe和稀H2SO4反应 2Fe+6H+═2Fe3++3H2↑ | |
| D. | 盐酸和Ba(OH)2溶液反应 H++OH-═H2O |
分析 A.HClO在离子反应中保留化学式;
B.碳酸钙在离子反应中保留化学式;
C.反应生成硫酸亚铁和氢气;
D.反应生成氯化钡和水.
解答 解:A.HClO与NaOH溶液反应的离子反应为HClO+OH-═H2O+ClO-,故A错误;
B.CaCO3与稀盐酸反应的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C.Fe和稀H2SO4反应的离子反应为Fe+2H+═Fe2++H2↑,故C错误;
D.盐酸和Ba(OH)2溶液反应的离子反应为H++OH-═H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.已知:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,现有容积相同的甲、乙、丙三个容器,在相同条件下分别充入的气体和反应放出的热量(Q)如下表所列:
根据以上数据,下列叙述正确的是( )
| 容器 | SO2(mol) | O2(mol) | N(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A. | 在上述条件下反应生成1molSO3气体放热98.5 kJ | |
| B. | Q1=2Q2=2Q3=197 kJ | |
| C. | 上述条件下1mol O2参加反应放出的热量为197 kJ/mol | |
| D. | Q2<Q3<Q1<197kJ |
14.有人认为目前已知化合物中数量最多的是有机化合物,下列关于其原因的叙述中不正确的是( )
| A. | 碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键 | |
| B. | 碳原子性质活泼,可以跟多数元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和叁键 | |
| D. | 多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合 |
11.下列表示氯及其化合物的化学用语正确的是( )
| A. | 中子数为20的氯原子符号:20Cl | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HClO4的电离方程式:HClO4═H++ClO4- | |
| D. | Cl-的结构示意图: |
1.要除去SiO2中混有的少量CaO杂质,最适宜的试剂是( )
| A. | 纯碱溶液 | B. | 盐酸 | C. | 硫酸 | D. | 苛性钠溶液 |
8.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 打开汽水瓶,有气泡从溶液中冒出 | |
| D. | 对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
6.在下列溶液中,分别加入少量的二氧化锰粉末,可能发生反应的是( )
| A. | KI溶液 | B. | 酸性KI溶液 | C. | KOH 溶液 | D. | K2CO3 溶液 |
 所示.
所示.
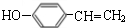 .
.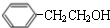 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$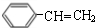 +H2O;C→D的反应类型为加成反应.
+H2O;C→D的反应类型为加成反应.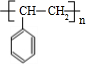 .
. )的叙述正确的是B(填字母序号)
)的叙述正确的是B(填字母序号)