题目内容
6.下列说法中正确的是( )| A. | 在铁质船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率,称为牺牲阴极的阳极保护法 | |
| B. | 电解饱和食盐水是将电能转变成化学能,在阴极附近生成氢氧化钠和氢气 | |
| C. | 铜锌原电池反应中,铜片作正极,产生气泡发生还原反应,电子从铜片流向锌片 | |
| D. | 外加电流的阴极保护法是将被保护的金属与外加电源的正极相连 |
分析 A、原电池负极发生氧化反应,锌比铁活泼,锌作阳极不断被腐蚀;
B、在外加电源的作用下,电解饱和食盐水,阴极上氢离子得电子;
C、原电池中电子从负极流向正极;
D、外加电流的阴极保护法应将被保护的金属应与外加电源的负极相连,作阴极被保护.
解答 解:A、在船体上镶嵌锌块,形成锌铁原电池,锌比铁活泼,锌作负极不断被腐蚀,铁做正极则不会被腐蚀,称为牺牲阳极的阴极保护法,故A错误;
B、在外加电源的作用下,电解饱和食盐水是将电能转变成化学能,阴极上氢离子得电子生成氢气,同时溶液中生成氢氧根离子,故B正确;
C、铜锌原电池反应中,Zn失电子作负极,铜片作正极,产生气泡发生还原反应,电子从锌片流向铜片,故C错误;
D、外加电流的阴极保护法应将被保护的金属与外加电源的负极相连,与正极相连作阳极会失电子被腐蚀,故D错误;
故选B.
点评 本题考查了金属的腐蚀与防护,题目难度中等,注意掌握金属的电化学腐蚀原理,明确金属防护常用的措施及原理,能够正确辩别电化学腐蚀与化学腐蚀的、析氢腐蚀与吸氧腐蚀.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
3.下列可能大量共存且溶液是无色的离子组是( )
| A. | H+、Na+、NO3-、MnO4- | B. | OH-、Ba2+、Cl-、SO42- | ||
| C. | HCO3-、K+、OH-、NO3- | D. | NO3-、SO42-、K+、Mg2+ |
4.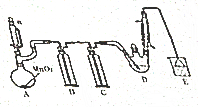 某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
①制备反应原理:C2H5OH+4Cl2→CCl4CHO+5HCl
可能发生副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
(1)仪器A中发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置B中的试剂是饱和食盐水
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行,为什么?不可行,CCl3COOH溶于乙醇与CCl3CHO
(4)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
 某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:①制备反应原理:C2H5OH+4Cl2→CCl4CHO+5HCl
可能发生副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行,为什么?不可行,CCl3COOH溶于乙醇与CCl3CHO
(4)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
14.下列污水处理过程,不涉及化学变化的是( )
| A. | 加入明矾净水 | B. | 过滤水中的不溶物 | ||
| C. | 调节水的pH | D. | 沉淀水中的Cu2+离子 |
1.要除去SiO2中混有的少量CaO杂质,最适宜的试剂是( )
| A. | 纯碱溶液 | B. | 盐酸 | C. | 硫酸 | D. | 苛性钠溶液 |
11.下列有关化学反应表达正确的是( )
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: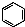 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$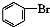 +HBr +HBr | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH$\stackrel{△}{→}$CH2=CH2+NaCl+H2O |
18.下列说法中错误的是( )
| A. | 从1 L 1 mol/L 的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| B. | 制成0.5 L 10 mol/L 的盐酸,需要氯化氢气体 112L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2 溶液中,Ba2+ 和Cl- 总数位3×6.02×1023 | |
| D. | 10 g 98% 硫酸 (密度为 1.84g/cm3)与10 mL 18.4 mol/L 硫酸的浓度是不同的 |
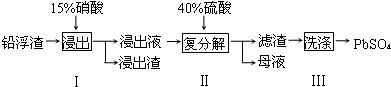
15.废弃物的综合利用既有利于节约资源,又有利于保护环境.工业上利用铅浮渣(主要成分是PbO、Pb还古有少量的Ag、CaO)可制备硫酸铅.制备流程图如下:
下表是25℃时某些盐的浓度积常数:
(1)实验室用75%的硝酸来配制15%的硝酸溶液,不需用到的玻璃仪器有CD(填标号).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒
(2)步骤I有NO产生,浸出液中含量最多的金属阳离子为 Pb2+,写出Pb参加反应的化学方程式
3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余.
(3)母液可循环利用于步骤I,其溶质主要是HNO3(填一种物质化学式),若母液中残留的 SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)粗PbSO4 产品含有的杂质是硫酸钙,需用Pb(NO3)2溶液多次洗涤,以得到纯净的PbSO4.
(5)铅蓄电池放电时正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸涪液浓度为4.50mol•L-1,当制得4.48LCl2时(在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)4 mol•L-1.

下表是25℃时某些盐的浓度积常数:
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒
(2)步骤I有NO产生,浸出液中含量最多的金属阳离子为 Pb2+,写出Pb参加反应的化学方程式
3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余.
(3)母液可循环利用于步骤I,其溶质主要是HNO3(填一种物质化学式),若母液中残留的 SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)粗PbSO4 产品含有的杂质是硫酸钙,需用Pb(NO3)2溶液多次洗涤,以得到纯净的PbSO4.
(5)铅蓄电池放电时正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸涪液浓度为4.50mol•L-1,当制得4.48LCl2时(在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)4 mol•L-1.
16.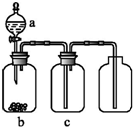 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )
 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )| 气体 | a | b | c | |
| A | CO2 | 稀盐酸 | CaCO3固体 | 浓硫酸 |
| B | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| C | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| D | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |