题目内容
11.按要求写出下列反应的方程式①NaHSO4溶液与NaHCO3溶液反应的离子方程式:HCO3-+H+═CO2↑+H2O
②在碳酸钠溶液中滴加少量盐酸:CO32-+H+═HCO3-
③在盐酸溶液中滴加少量碳酸钠溶液:CO32-+2H+═CO2↑+H2O
④在澄清石灰水中通入过量二氧化碳:CO2+OH-═HCO3-
⑤已知离子反应甲:Cl2+2I-═2Cl-+I2及反应乙:I2+SO32-+H2O═2H++2I-+SO42-.现向NaI与Na2SO3的混合溶液中缓缓通入Cl2,溶液中首先发生的反应的离子方程式为:Cl2+SO32-+H2O═2H++2Cl-+SO42-.
分析 ①反应生成硫酸钠、水、二氧化碳;
②反应生成氯化钠、碳酸氢钠;
③反应生成氯化钠、水、二氧化碳;
④反应生成碳酸氢钙;
⑤由已知离子反应可知,还原性SO32->I-,向NaI与Na2SO3的混合溶液中缓缓通入Cl2,先氧化SO32-.
解答 解:①反应生成硫酸钠、水、二氧化碳,离子反应为HCO3-+H+═CO2↑+H2O,故答案为:HCO3-+H+═CO2↑+H2O;
②反应生成氯化钠、碳酸氢钠,离子反应为CO32-+H+═HCO3-,故答案为:CO32-+H+═HCO3-;
③反应生成氯化钠、水、二氧化碳,离子反应为CO32-+2H+═CO2↑+H2O,故答案为:CO32-+2H+═CO2↑+H2O;
④反应生成碳酸氢钙,离子反应为CO2+OH-═HCO3-,故答案为:CO2+OH-═HCO3-;
⑤由已知离子反应可知,还原性SO32->I-,向NaI与Na2SO3的混合溶液中缓缓通入Cl2,先氧化SO32-,离子反应为Cl2+SO32-+H2O═2H++2Cl-+SO42-,
故答案为:Cl2+SO32-+H2O═2H++2Cl-+SO42-.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
1.向下列液体中滴加稀硫酸,开始时生成沉淀,继续滴加稀H2SO4沉淀又溶解的是( )
| A. | Na2CO3溶液 | B. | BaCl2溶液 | C. | NaAlO2溶液 | D. | Fe(OH)3胶体 |
2.中草药秦皮中含有的七叶树内酯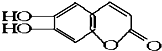 ,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )
,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )
 ,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )
,具有抗菌作用.若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为 ( )| A. | 3mol Br2;2mol NaOH | B. | 3mol Br2;4mol NaOH | ||
| C. | 2mol Br2;3mol NaOH | D. | 4mol Br2;4mol NaOH |
19.下列各组溶液,采用化学方法,不用其它试剂即可鉴别的是( )
| A. | CuSO4 NaCl | B. | NaHCO3 H2SO4 | ||
| C. | AlCl3 氨水 | D. | NaAlO2 HCl |
6.25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-393.5 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H=-890.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(1)△H=+571.6 kJ/mol | |
| D. | $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(g)△H=-1400 kJ/mol |
16.下列有关四个常用电化学装置的叙述正确的是( )
| A. | 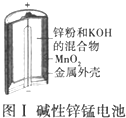 图Ⅰ所示电池中,MnO2的作用是催化剂 | |
| B. | 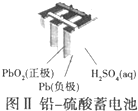 图Ⅱ所示电池工作时,负极质量减轻 | |
| C. | 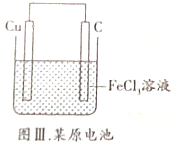 图Ⅲ所示装置工作过程中,Cu作正极 | |
| D. | 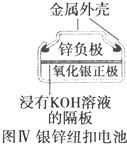 图Ⅳ所示电池为一次电池 |
3.下列物质或离子间转化,不能一步反应完成的是( )
| A. | SiO2→H2SiO3 | B. | Al→AlO2- | C. | Na2CO3→NaOH | D. | Fe→Fe2+ |

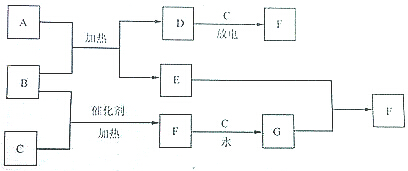 中学化学中常见的物质之间的转化关系如下图所示(有些反应中的部分物质和条件被略去).在通常状况下,A为黑色金属氧化物的固体;B为无色有刺激性气味的气体,且其水溶液呈碱性;C、D均为无色的气体单质,C具有助燃性,D是大气中含量最多的物质;E为紫红色的金属单质,其硫酸盐常用于游泳池水的杀菌消毒剂.
中学化学中常见的物质之间的转化关系如下图所示(有些反应中的部分物质和条件被略去).在通常状况下,A为黑色金属氧化物的固体;B为无色有刺激性气味的气体,且其水溶液呈碱性;C、D均为无色的气体单质,C具有助燃性,D是大气中含量最多的物质;E为紫红色的金属单质,其硫酸盐常用于游泳池水的杀菌消毒剂. .
.