题目内容
3.某小组同学用如图所示装置研究电化学原理.下列关于该原电池的说法不正确的是( )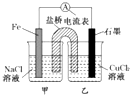
| A. | 原电池的总反应为 Fe+Cu2+=Fe2++Cu | |
| B. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2 mol电子 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑ | |
| D. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 |
分析 该原电池中Fe作负极,负极反应为Fe-2e-═Fe2+,C作正极,正极上是溶液中的阳离子得电子,则正极反应为Cu2++2e-=Cu,溶液中阴离子向负极移动,结合电子转移计算.
解答 解:A、负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-=Cu,则原电池的总反应为Fe+Cu2+═Fe2++Cu,故A正确;
B、Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
12g n
解得:n=0.2mol,故B正确;
C、其他条件不变,若将CuCl2溶液换为NH4Cl溶液,溶液中的氢离子在正极上得电子,则石墨电极反应式为2H++2e-═H2↑,故C正确;
D、盐桥中是KNO3溶液,则盐桥中NO3-移向负极移动,即向甲烧杯,故D错误.
故选D.
点评 本题考查了原电池原理的分析应用,把握电极反应和电极判断、电子守恒的计算应用是解题关键,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列有机物命名正确的是( )
| A. | 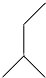 (2-乙基丙烷) (2-乙基丙烷) | B. | CH3CH2CH2CH2OH(1-丁醇) | ||
| C. |  (间二甲苯) (间二甲苯) | D. | CH3C(CH3)=CH2(2-甲基-2-丙烯) |
11.镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.150℃时,Ni(CO)4分解为Ni和CO.则下列可作为溶解Ni(CO)4的溶剂是( )
| A. | 水 | B. | 四氯化碳 | C. | 盐酸 | D. | 硫酸镍溶液 |
18.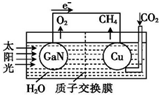 最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
 最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )| A. | 该装置只有化学能转化为电能 | |
| B. | 氮化镓电极是阴极 | |
| C. | 导线中经过2mol的电子,氮化镓电极生成1molO2 | |
| D. | 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O |
12.研究证明,CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下:
反应开始时在0.l MPa下,以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的物质的量百分数如图1所示,请回答下列问题:
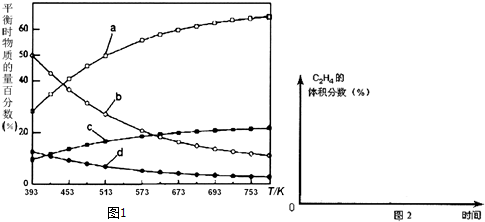
(1)△H4=-128 kJ/mol.
(2)可判断该反应体系已平衡的是CE.
A.v (CO2)=2v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为H2(写化学式),判断依据是由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值.
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01kJ•mol-1 |
| 反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

(1)△H4=-128 kJ/mol.
(2)可判断该反应体系已平衡的是CE.
A.v (CO2)=2v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为H2(写化学式),判断依据是由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值.
 .
.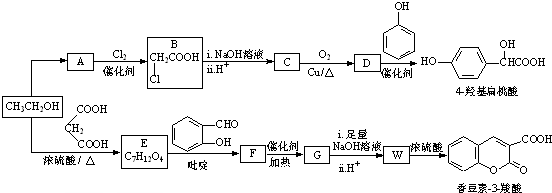
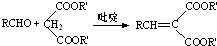 (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基) $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$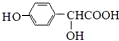 .
.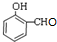 $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$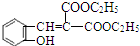 +H2O.
+H2O.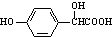 )的同分异构体
)的同分异构体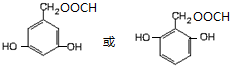 .
.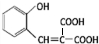 $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$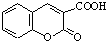 +H2O.
+H2O.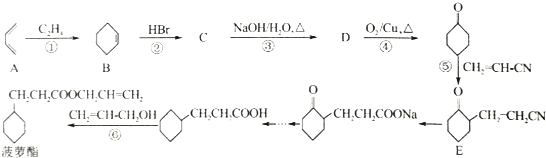
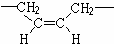 ,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001.
,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001.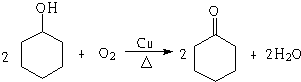 .
.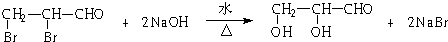 .
.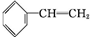 +Br2
+Br2
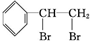 .
.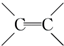 $\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$
$\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$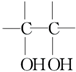 .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式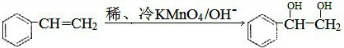 .
. .
.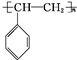 .
.