题目内容
在体积相同的两个密闭容器中分别充满NO、NO2,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
| A、两种气体的压强相等 |
| B、两种气体的氮原子数目不相等 |
| C、两种气体的分子数目相等 |
| D、NO比NO2的质量小 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:相同体积相同密度时,两容器气体的质量相等,根据PV=nRT、N=
NA、根据m=ρV结合分子构成分析解答.
| m |
| M |
解答:
解:相同体积相同密度时,两容器气体的质量相等,
A.两种气体的摩尔质量不等,所以其物质的量不等,根据PV=nRT知,温度、物质的量相同时,其压强不等,故A错误;
B.根据N=
NA知,两种气体的质量相等时,其摩尔质量不等,所以其分子数不等,每个一氧化氮和二氧化氮分子中氮原子个数相等,所以分子数不等的一氧化氮和二氧化氮中其氮原子个数不等,故B正确;
C.根据N=
NA知,两种气体的质量相等时,其摩尔质量不等,所以其分子数不等,故C错误;
D.根据m=ρV知,二者的质量相等,故D错误;
故选B.
A.两种气体的摩尔质量不等,所以其物质的量不等,根据PV=nRT知,温度、物质的量相同时,其压强不等,故A错误;
B.根据N=
| m |
| M |
C.根据N=
| m |
| M |
D.根据m=ρV知,二者的质量相等,故D错误;
故选B.
点评:本题考查了阿伏伽德罗定律及其推论,熟练运用基本公式是解本题关键,根据公式中的物理量结合分子构成分析解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式正确的是( )
| A、Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O |
| B、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
| C、100mL 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓ |
在常温下的Al2(SO4)3、K2SO4和H2SO4的混和溶液中,若pH=1,c(SO42-)=0.8mol/L,c(Al3+)=0.4mol/L,则K+的物质的浓度为( )
| A、0.1 mol/L |
| B、0.2 mol/L |
| C、0.3 mol/L |
| D、0.4 mol/L |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、18g D2O含有电子数为9NA |
| B、标准状况下,11.2L乙酸中含有的分子数目为0.5NA |
| C、78g Na2O2中含有的离子总数为4NA |
| D、1L 1mol?L-1 Na2CO3溶液中,溶液中CO32-离子数是NA |
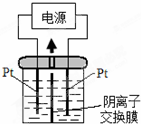 电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )| A、右侧发生的电极方程式:O2+4e-+2H2O=4OH- |
| B、电解槽内发生反应的总化学方程式是KI+3H2O=KIO3+3H2↑ |
| C、电解结束后,右侧溶液中不可能含有IO3- |
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、2mol Na被完全氧化生成1mol Na2O2,得到2NA个电子 |
| B、25℃时pH=13的NaOH液中含有OH一的数目为0.1NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
| D、等物质的量的HCN与NaCN混合后溶液显碱件.则溶液中c(CN-)<c(HCN) |
 断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:
断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E: 如图是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.
如图是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.