题目内容
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、2mol Na被完全氧化生成1mol Na2O2,得到2NA个电子 |
| B、25℃时pH=13的NaOH液中含有OH一的数目为0.1NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
| D、等物质的量的HCN与NaCN混合后溶液显碱件.则溶液中c(CN-)<c(HCN) |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.Na反应生成Na2O2失去电子;
B.pH=13的NaOH溶液中,没有告诉溶液的体积,无法计算氢氧化钠的物质的量;
C.依据标准状况下气体物质的量n=
,结合二氧化氮和水反应生成硝酸和一氧化氮的氧化还原反应计算电子转移;
D.水解程度大于电离程度.
B.pH=13的NaOH溶液中,没有告诉溶液的体积,无法计算氢氧化钠的物质的量;
C.依据标准状况下气体物质的量n=
| V |
| 22.4 |
D.水解程度大于电离程度.
解答:
解:A.2mol Na被完全氧化生成1mol Na2O2,失去2NA个电子,故A错误;
B.题中没有告诉溶液的体积,无法计算氢氧化钠的物质的量,故B错误;
C.标准状况下气体物质的量n=
=
=0.3mol,二氧化氮和水反应生成硝酸和一氧化氮的反应为3NO2+H2O=2HNO3+NO,氧化还原反应中0.3mol二氧化氮反应转移电子0.2mol,故C错误;
D.水解程度大于电离程度,只考虑水解,溶液中c(CN-)<c(HCN),故D正确.
故选D.
B.题中没有告诉溶液的体积,无法计算氢氧化钠的物质的量,故B错误;
C.标准状况下气体物质的量n=
| V |
| 22.4 |
| 6.72L |
| 22.4L/mol |
D.水解程度大于电离程度,只考虑水解,溶液中c(CN-)<c(HCN),故D正确.
故选D.
点评:本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
在体积相同的两个密闭容器中分别充满NO、NO2,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
| A、两种气体的压强相等 |
| B、两种气体的氮原子数目不相等 |
| C、两种气体的分子数目相等 |
| D、NO比NO2的质量小 |
下列离子方程式书写不正确的是( )
| A、等物质的量的 CO2与氢氧化钠溶液反应:CO2+OH-=HCO3- | ||||
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | ||||
| C、Ca(OH)2溶液与等物质的量的稀H2SO4混合:Ca2++2OH-+2H++SO42-═CaSO4↓+2H2O | ||||
D、用石墨电极电解饱和食盐水:2H2O+2Cl-
|
某课外实验小组设计的下列实验不合理的是( )
A、 实验室制备少量氨气 |
B、 分离C2H5OH和H2O的混合物 |
C、 证明过氧化钠与水反应放热 |
D、 收集H2、Cl2、NO2等气体 |
关于下列图示的说法中正确的( )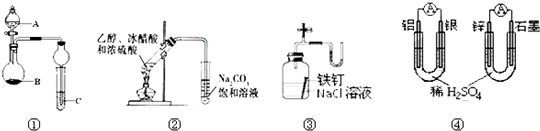

| A、图①中,若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、图②制备乙酸乙酯 |
| C、图③证明铁生锈与空气有关 |
| D、图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
分类是学习和研究化学的一种的重要方法,下列分类合理的是( )
| A、K2CO3和K2O都属于盐 |
| B、H2SO4和HNO3都属于酸 |
| C、KOH和Na2CO3都属于碱 |
| D、Na2O和Na2SiO3都属于氧化物 |
如图为铜锌原电池示意图,下列说法不正确的是( )


| A、反应物是锌和稀硫酸 |
| B、铜片做阳极 |
| C、电流计显示导线上电子由锌片流向铜片 |
| D、该装置能将化学能转变为电能 |