题目内容
 如图是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.
如图是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R基态原子的核外电子排布图为
(2)在化合物YZ2中Y的化合价为
(3)在X、Y、Z三种元素中,电负性由大到小的排序是
(4)在双原子分子中,最稳定单质的电子式为
(5)在这6种元素的单质中,熔沸点最高的是(填化学式)
(6)由X、Y、Z、R、W五种元素的原子构成的两种3原子分子有如下反应:

(分子模型中的“-”表示共价键--单键、双键、三键或其他特殊的共价键,白球表示的原子可以相同也可以不相同)
则其具体的反应方程式可以是
(7)在很长时期内未制得WY4-,直到1971年有化学家将JZ2和含WY3-的溶液作用才获得成功,反应除生成WY4-外,还有一种酸HZ和一种单质.写出其离子反应方程式并标出电子转移数目和方向(只有J可以不必用具体的元素符号)
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:图是元素周期表前五周期的一部分,由元素在周期表中的位置可知,X为氮元素、Y为氧元素、Z为氟元素、R为硫元素、W为Br、J为Xe,
(1)R为硫元素,原子核外有16个电子,根据核外电子排布规律画出核外电子排布图;
(2)F元素电负性大于氧元素,故OF2中F元素为-1,结合化合价规则计算O元素化合价;O2-与Na+离子电子层结构相同,核电荷数越大离子半径越小;
(3)同周期自左而右电负性增大、第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于相邻元素;
(4)氮气分子中存在N≡N三键,化学性质最稳定,HN3溶液与NaOH发生中和反应生成NaX3与水;
(5)根据单质的状态判断熔沸点高低;
(6)可以是二氧化硫与二氧化氮反应得到三氧化硫与NO等;
(7)XeF2和含BrO3-的溶液作用,反应除生成BrO4-外,还有一种酸HF和一种单质,由元素守恒可知没改单质为Xe,反应离子方程式为:XeF2+BrO3-+H2O=BrO4-+2HF+Xe↑,转移电子数为2.
(1)R为硫元素,原子核外有16个电子,根据核外电子排布规律画出核外电子排布图;
(2)F元素电负性大于氧元素,故OF2中F元素为-1,结合化合价规则计算O元素化合价;O2-与Na+离子电子层结构相同,核电荷数越大离子半径越小;
(3)同周期自左而右电负性增大、第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于相邻元素;
(4)氮气分子中存在N≡N三键,化学性质最稳定,HN3溶液与NaOH发生中和反应生成NaX3与水;
(5)根据单质的状态判断熔沸点高低;
(6)可以是二氧化硫与二氧化氮反应得到三氧化硫与NO等;
(7)XeF2和含BrO3-的溶液作用,反应除生成BrO4-外,还有一种酸HF和一种单质,由元素守恒可知没改单质为Xe,反应离子方程式为:XeF2+BrO3-+H2O=BrO4-+2HF+Xe↑,转移电子数为2.
解答:
解:图是元素周期表前五周期的一部分,由元素在周期表中的位置可知,X为氮元素、Y为氧元素、Z为氟元素、R为硫元素、W为Br、J为Xe,
(1)R为硫元素,原子核外有16个电子,根据核外电子排布规律,核外电子排布图为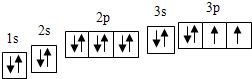 ,
,
故答案为: ;
;
(2)F元素电负性大于氧元素,故OF2中F元素为-1,故O元素化合价为+2;O2-与Na+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+,
故答案为:+2;O2->Na+;
(3)同周期自左而右电负性增大、第一电离能呈增大趋势,但N原子的2p轨道电子数为半满稳定状态,能量较低,失去电子需要的能量较高,第一电离能高于相邻元素,故电负性F>O>N,第一电离能N>O,
故答案为:F>O>N;>;N原子的2p轨道电子数为半满稳定状态,能量较低,失去电子需要的能量较高;
(4)氮气分子中存在N≡N三键,化学性质最稳定,其电子式为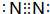 ,HN3溶液与NaOH发生中和反应生成NaX3与水,反应离子方程式为:HN3+OH-═N3-+H2O,
,HN3溶液与NaOH发生中和反应生成NaX3与水,反应离子方程式为:HN3+OH-═N3-+H2O,
故答案为: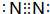 ;HN3+OH-═N3-+H2O;
;HN3+OH-═N3-+H2O;
(5)常温下氮气、氧气、氟气、氙为气体,溴为液态、硫为固体,故硫的熔沸点最高,故答案为:S;
(6)可以是二氧化硫与二氧化氮反应得到三氧化硫与NO等,反应方程式为SO2+NO2═SO3+NO等,故答案为:SO2+NO2═SO3+NO等;
(7)XeF2和含BrO3-的溶液作用,反应除生成BrO4-外,还有一种酸HF和一种单质,由元素守恒可知没改单质为Xe,反应离子方程式为:XeF2+BrO3-+H2O=BrO4-+2HF+Xe↑,转移电子数为2,标出电子转移数目和方向为 ,
,
故答案为: .
.
(1)R为硫元素,原子核外有16个电子,根据核外电子排布规律,核外电子排布图为
 ,
,故答案为:
 ;
;(2)F元素电负性大于氧元素,故OF2中F元素为-1,故O元素化合价为+2;O2-与Na+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+,
故答案为:+2;O2->Na+;
(3)同周期自左而右电负性增大、第一电离能呈增大趋势,但N原子的2p轨道电子数为半满稳定状态,能量较低,失去电子需要的能量较高,第一电离能高于相邻元素,故电负性F>O>N,第一电离能N>O,
故答案为:F>O>N;>;N原子的2p轨道电子数为半满稳定状态,能量较低,失去电子需要的能量较高;
(4)氮气分子中存在N≡N三键,化学性质最稳定,其电子式为
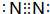 ,HN3溶液与NaOH发生中和反应生成NaX3与水,反应离子方程式为:HN3+OH-═N3-+H2O,
,HN3溶液与NaOH发生中和反应生成NaX3与水,反应离子方程式为:HN3+OH-═N3-+H2O,故答案为:
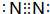 ;HN3+OH-═N3-+H2O;
;HN3+OH-═N3-+H2O;(5)常温下氮气、氧气、氟气、氙为气体,溴为液态、硫为固体,故硫的熔沸点最高,故答案为:S;
(6)可以是二氧化硫与二氧化氮反应得到三氧化硫与NO等,反应方程式为SO2+NO2═SO3+NO等,故答案为:SO2+NO2═SO3+NO等;
(7)XeF2和含BrO3-的溶液作用,反应除生成BrO4-外,还有一种酸HF和一种单质,由元素守恒可知没改单质为Xe,反应离子方程式为:XeF2+BrO3-+H2O=BrO4-+2HF+Xe↑,转移电子数为2,标出电子转移数目和方向为
 ,
,故答案为:
 .
.
点评:本题考查结构性质位置关系综合应用,涉及核外电子排布、电负性、电离能、氧化还原反应、信息提取能力等,侧重考查学生分析解决问题能力,需要学生具备扎实的基础,难度中等.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
在体积相同的两个密闭容器中分别充满NO、NO2,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
| A、两种气体的压强相等 |
| B、两种气体的氮原子数目不相等 |
| C、两种气体的分子数目相等 |
| D、NO比NO2的质量小 |
分类是学习和研究化学的一种的重要方法,下列分类合理的是( )
| A、K2CO3和K2O都属于盐 |
| B、H2SO4和HNO3都属于酸 |
| C、KOH和Na2CO3都属于碱 |
| D、Na2O和Na2SiO3都属于氧化物 |
如图为铜锌原电池示意图,下列说法不正确的是( )


| A、反应物是锌和稀硫酸 |
| B、铜片做阳极 |
| C、电流计显示导线上电子由锌片流向铜片 |
| D、该装置能将化学能转变为电能 |
环境污染已经成为我国必须面对的首要社会问题.引起下列环境污染的原因或处理方法(包括对应的化学方程式)中不正确的是( )
| A、SO2、氮氧化物和可吸入颗粒物是导致雾霾产生的主要原因之一 | ||||
| B、装饰材料中的甲醛、芳香烃及氡等会造成居室污染 | ||||
C、用催化氧化法处理汽车尾气中的CO和NO:CO+NO
| ||||
| D、向污水中投放明矾,利用生成的胶体净水:Al3++3H2O?Al(OH)3(胶体)+3H+ |
