题目内容
11.某学生利用图1实验装置探究盐桥式原电池的工作原理图,按照要求依次回答下列问题: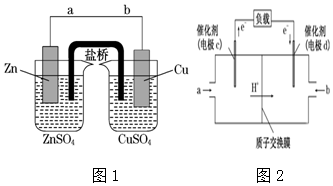
(1)写出该氧化还原反应的离子方程式:Zn+Cu2+=Zn2++Cu
(2)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是B.
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)已知该原电池装置在反应前两电极质量相等,一段时间后两极质量相差12.9g则导线中通过的电子数目为0.2NA (用“NA”表示);
(4)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则原电池的负极材料是锌,正极发生的电极反应为:O2+4H++4e-═2H2O.
(5)用CH4和O2组合形成的质子交换膜燃料电池的结构示意图如图3:①则d电极是正极(填“正极”或“负极”)C电极的反应方程式为:CH4-8e-+2H2O═CO2+8H+
②若电路中转移4mol电子,则上述燃料电池消耗的O2在标准状况下的体积为22.4L.
③电池工作一段时间后溶液的酸性减弱(填“增强”“减弱”或“不变”)
分析 (1)该原电池反应的实质是Zn与铜离子的置换反应;
(2)根据正负极判断阴阳离子的移动方向;
(3)负极上锌失电子质量减小,正极上铜离子得电子生成Cu质量增大,根据转移电子数相同计算;
(4)根据电池反应式知,锌失电子发生氧化反应而作负极,氧气在正极得电子发生还原反应,根据电极反应式计算;
(5)①原电池中电子从负极经外电路流向正极,负极反应氧化反应,结合电解质书写电极反应式;
②根据关系式O2~4e-来计算;
③根据电池的总反应判断溶液酸性变化.
解答 解:(1)该原电池反应的实质是Zn与铜离子的置换反应,反应的离子方程式为:Zn+Cu2+=Zn2++Cu;
故答案为:Zn+Cu2+=Zn2++Cu;
(2)左侧烧杯中锌失电子变成锌离子,使得锌电极附近带正电荷,吸引阴离子向左侧烧杯移动,右侧烧杯中铜离子得到电子变成铜,使得铜电极附近带负电荷,吸引阳离子向右侧烧杯移动,故盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动,
故答案为:B;
(3)设转移电子为xmol,则由正极反应式Cu2++2e-=Cu可知,生成0.5xmol铜,由负极反应式Zn-2e-=Zn2++可知,消耗Zn为0.5xmol,
则64×0.5x+65×0.5x=12.9,解得x=0.2,所以转移电子数为0.2NA;
故答案为:0.2NA;
(4)根据电池反应式知,锌失电子发生氧化反应,所以锌作负极,电极反应式为:2Zn-4e-═2Zn2+,氧气在正极得电子发生还原反应,电极反应式为:O2+4H++4e-═2H2O;
故答案为:锌;O2+4H++4e-═2H2O;
(5)①因c是电子流出的一极,则c为负极,d为正极,甲烷具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH4-8e-+2H2O═CO2+8H+,
故答案为:正极;CH4-8e-+2H2O═CO2+8H+;
②原电池中正极电极反应为2O2+8H++8e-═4H2O,当转移4mol电子时,则生成氧气物质的量为1mol,体积为1mol×22.4L/mol=22.4L;
故答案为:22.4;
③电池中发生的反应为CH4和O2反应生成二氧化碳和水,方程式为:CH4+2O2=CO2+2H2O,反应生成水,溶液的体积增大,氢离子浓度减小酸性减弱;
故答案为:减弱.
点评 本题考查原电池以及燃料电池的工作原理,注意电解质溶液的酸碱性不同,则电极反应不同,根据得失电子判断正负极,难点是电极反应式的书写,属于综合知识的考查,难度中等,侧重于考查学生对基础知识的应用能力.

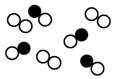
(1)图表示容器中气体粒子的示意图,图中“○”和“●”分别代表不同元素的原子,它们的结合体代表分子,则图中可表示氮气的是D,可表示氯化氢(HCl)分子的是B,可表示一氧化碳和氧气的混合气体的是C(填序号).
 |  |  |  |
| A | B | C | D |
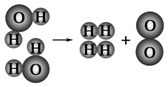
A.生成1mol O2需断开4mol H-O共价键
B.水分解后生成氢气和氧气的分子数比为2:1
C.水分解过程中,分子的种类不变
D.水分解过程中,原子的数目不变
(3)表各图中的小球代表原子序数从1~18元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键.下列各图表示的结构与化学式一定不相符的是C(填序号).
| A | B | C |
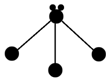 |  |  |
| NH3 | CO2 | CCl4 |
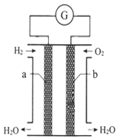 氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )
氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )| A. | 在电池反应中每转移2mol电子,正极消耗O2的体积为11.2L | |
| B. | b极的电极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液碱性减弱 | |
| D. | 该装置将化学能转化为电能 |
| A. | 加入适量的水 | B. | 加入适量的NaOH固体 | ||
| C. | 通入适量的SO2 | D. | 加入适量的CuSO4固体 |
| A. | CH3CH2CH2Cl在碱性溶液中水解 | |
| B. | CH2═CH-CH═CH2与H2按物质的量之比为1:1进行反应 | |
| C. | CH3CH═CH2与HCl加成 | |
| D. |  与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
| A. | 由乙酸和乙醇生成乙酸乙酯的反应类型和由溴乙烷生成乙烯的反应类型相同 | |
| B. | 糖类、油脂和蛋白质均能发生水解反应 | |
| C. | 丙烯在一定条件下可与氯气发生取代反应生成3-氯丙烯 | |
| D. | 甲苯与氯气在光照下发生取代反应主要生成2,4二氯甲苯 |
| A. | X- | B. | 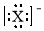 | C. | 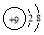 | D. |  |

 在5-氨基四唑(
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.