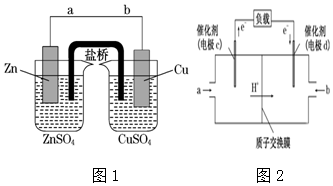
题目内容
16.20℃时,H2S的饱和溶液1L,其浓度为0.1mol/L,若要使溶液的pH增大的同时c(S2-)增大,可采取的措施是( )| A. | 加入适量的水 | B. | 加入适量的NaOH固体 | ||
| C. | 通入适量的SO2 | D. | 加入适量的CuSO4固体 |
分析 H2S的饱和溶液中存在的电离平衡H2S?H++HS-、HS-?H++S2-,若要使溶液的pH增大的同时c(S2-)增大,加入的物质能和氢离子反应但不能和硫离子反应,据此分析解答.
解答 解:A.加入适量的水,促进硫化氢电离,但硫化氢的电离增大程度小于溶液体积增大程度,所以c(S2-)、c(H+)都减小,故A错误;
B.加入适量的NaOH固体,NaOH和硫化氢反应生成硫化钠和水,导致氢离子浓度减小,c(S2-)增大,故B正确;
C.通入适量二氧化硫,二氧化硫和硫化氢反应生成S和水,溶液的pH增大,但c(S2-)减小,故C错误;
D.加入适量的硫酸铜固体,硫化氢和硫酸铜反应生成CuS沉淀和硫酸,氢离子浓度增大,溶液的pH减小,c(S2-)减小,故D错误;
故选B.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断能力,明确物质之间发生的反应是解本题关键,注意A中虽然促进硫化氢电离,但溶液的pH增大,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列说法正确的是( )
| A. | 金刚石和石墨互为同分异构体,熔点和硬度都很高 | |
| B. | 12C、13C、14C是碳元素的三种核素,互称为同位素 | |
| C. | 乙醇和二甲醚(CH3-O-CH3)互为同系物 | |
| D. | C4H10的一氯代物只有一种 |
4.理论上不能设计为原电池的化学反应是( )
| A. | 2C O (g)+O2(g)═2CO2(g) | B. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l) | ||
| C. | 2H2(g)+O2(g)═2H2O(l) | D. | Zn(s)+Ag2 O(s)═Zn O(s)+2Ag(s) |
1.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 分别用乙烷和乙烯制备氯乙烷的反应类型完全相同 |
8.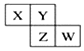 如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
 如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )| A. | X、Y对应的氧化物都是酸性氧化物 | |
| B. | X的氧化物不能与Mg发生化学反应 | |
| C. | Z比Y更容易与氢气化合 | |
| D. | W与X形成的化合物中化学键类型为共价键 |
5.关于实验,下列说法正确的是( )
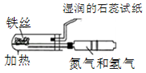 | 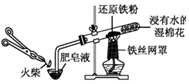 |
| A.模拟工业制氨气并检验产物 | B.一段时间后,试管中固体变为红棕色 |
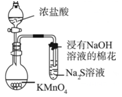 | 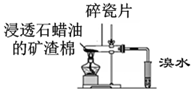 |
| C.可用所示装置比较KMnO4、Cl2、S的氧化性强弱 | D.若溴水褪色则证明石蜡油分解产生乙烯 |
| A. | A | B. | B | C. | C | D. | D |
11.设NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 1mol CaC2中有3NA个离子 | |
| B. | 1mol SiO2中含有2NA个共价键 | |
| C. | 1L 1mol/L CH3COONa溶液中含NA个CH3COO-离子 | |
| D. | 42g C2H4和C3H6的混合物中一定含有6NA个氢原子 |