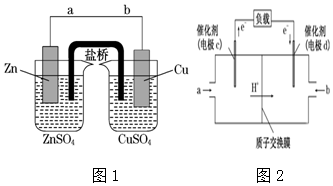
题目内容
2.砷(As)是第四周期第V A族元素,用化学用语回答问题:(1)砷的最高价氧化物对应的水化物化学式是H3AsO4,气态氢化物的稳定性ASH3小于(填写“大于”或“小于”)NH3.
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在.雄黄和雌黄的转换关系如图1所示:
①气体物质a是SO2(填化学式).
②第I步反应的离子方程式是2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+.
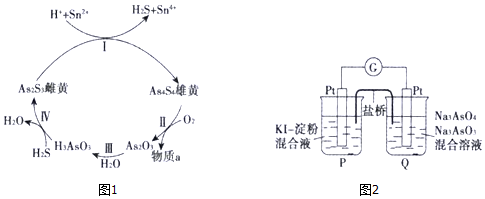
(3)Na2HAsO3溶液呈碱性,原因是HAsO32-+H2O?H2AsO3-+OH-(用离子方程式表示),该溶液中c(H2AsO3-)> c(AsO33-)(填“>”、“<”或“=”).
(4)某原电池装置如图2所示,电池总反应为AsO43-++2I-+H2O?AsO33-+I2+2OH-.当P池中溶液由无色变蓝色时,正极上的电极反应式为AsO43-+2e-+H2O=AsO33-+2OH-;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是I2+2e-=2I-.
分析 (1)As元素的最高正价为+5价,最高价氧化物对应的水化物化学式与磷酸相似;同主族从上到下,氢化物的稳定性减弱;
(2)①雄黄在空气中加热至300℃时会 两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),依据原子守恒可知另一种氧化物为二氧化硫;
②依据转化关系分析可知,雌黄(As2S3)酸性溶液中和Sn2+离子发生氧化还原反应生成As4S4、H2S、Sn4+,结合电荷守恒、原子守恒配平书写离子方程式;
(3)Na2HAsO3溶液呈碱性,是因为HAsO32-在溶液中发生水解反应;HAsO32-的水解程度大于电离程度;
(4)电池总反应为AsO43-+2I-+H2O?AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池生成I2,发生氧化反应,是负极,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,P为正极,P池中I2得电子还原为I-.
解答 解:(1)As元素的最高正价为+5价,最高价氧化物对应的水化物化学式与磷酸相似,则砷的最高价氧化物对应的水化物化学式是H3AsO4;同主族从上到下,氢化物的稳定性减弱,则气态氢化物的稳定性AsH3小于NH3;
故答案为:H3AsO4;小于;
(2)①雄黄在空气中加热时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为:As4S4+7O2$\frac{\underline{\;加热\;}}{\;}$2As2O3+4SO2,另一种氧化物为二氧化硫;
故答案为:SO2;
②依据转化关系分析可知,雌黄(As2S3)酸性溶液中和Sn2+离子发生氧化还原反应生成As4S4、H2S、Sn4+,结合电荷守恒、原子守恒配平书写离子方程式为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+,
故答案为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+;
(3)Na2HAsO3溶液呈碱性,是因为HAsO32-在溶液中发生水解反应,其水解反应的离子方程式为HAsO32-+H2O?H2AsO3-+OH-;Na2HAsO3溶液呈碱性,说HAsO32-的水解程度大于电离程度,所以该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:HAsO32-+H2O?H2AsO3-+OH-;>;
(4)电池总反应为AsO43-+2I-+H2O?AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池生成I2,发生氧化反应,是负极,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,则正极的电极方程式为AsO43-+2e-+H2O=AsO33-+2OH-;加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,P为正极,P池中I2得电子还原为I-,电极方程式为:I2+2e-=2I-;
故答案为:AsO43-+2e-+H2O=AsO33-+2OH-; I2+2e-=2I-.
点评 本题以As及其化合物的性质为研究对象,综合考查了水解平衡与电离平衡、氧化还原反应的分析与计算、原电池原理及平衡的移动等,题目难度中等,对提高学生分析问题解决问题的能力培养有一定帮助,注意从得失电子的角度分析原电池反应.

| A. | I2 | B. | Si3N4 | C. | CO2 | D. | Si |
| A. | 在水蒸气、液态水和冰中,水分子都在不停地运动 | |
| B. | NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl- | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 |
| A. | 凑近集气瓶中闻氯气的气味 | |
| B. | 圆底烧瓶可以用酒精灯直接加热 | |
| C. | 金属钠着火时,用沙子扑灭 | |
| D. | 浓盐酸沾到皮肤上,用氢氧化钠溶液冲洗 |
| A. | 金刚石和石墨互为同分异构体,熔点和硬度都很高 | |
| B. | 12C、13C、14C是碳元素的三种核素,互称为同位素 | |
| C. | 乙醇和二甲醚(CH3-O-CH3)互为同系物 | |
| D. | C4H10的一氯代物只有一种 |
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | + | =1 | - | + | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
| A. | 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧ | |
| B. | 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4 | |
| C. | 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族 | |
| D. | 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式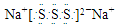 |
 短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径Z>X>Y>W | B. | 丙的热稳定性不如甲 | ||
| C. | X的最高价氧化物的水化物为强酸 | D. | Z的最高价氧化物的水化物为强碱 |
 如图所示实验装置可用于制取乙炔.请填空:
如图所示实验装置可用于制取乙炔.请填空: