题目内容
某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.
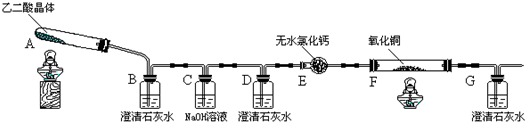
为探究草酸的部分化学性质,进行了如下实验:将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末
变红.据此回答:
(1)上述装置中,D的作用是 .乙二酸分解的化学方程式为 .
(2)该小组同学将0.02mol草酸晶体(H2C2O4?2H2O)加入到100mL 0.2mol?L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是 (用文字简单表述).
(3)(2)中反应后溶液中各离子的浓度由大到小的顺序为: .
为探究草酸的部分化学性质,进行了如下实验:将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末
变红.据此回答:
(1)上述装置中,D的作用是
(2)该小组同学将0.02mol草酸晶体(H2C2O4?2H2O)加入到100mL 0.2mol?L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是
(3)(2)中反应后溶液中各离子的浓度由大到小的顺序为:
考点:性质实验方案的设计
专题:实验设计题
分析:(1)乙二酸分解的化学方程式为H2C2O4
H2O+CO↑+CO2↑,由各物质的性质可推测装置的作用;
(2)两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度;
(3)根据NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于其水解程度,可得离子浓度间的大小关系.
| ||
(2)两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度;
(3)根据NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于其水解程度,可得离子浓度间的大小关系.
解答:
解:(1)乙二酸分解的化学方程式为H2C2O4
H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成,
故答案为:除去混合气体中的CO2;H2C2O4
H2O+CO↑+CO2↑;
(2)两者正好1:1反应生成NaHC2O4,溶液显酸性,说明HC2O4-的电离程度大于其水解程度,
故答案为:反应生成NaHC2O4,HC2O4-的电离程度大于其水解程度;
(3)两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度,而溶液中还存在着水的电离,故H+>C2O42-,由于离子的电离程度较小,则有HC2O4->H+,故正确顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
| ||
故答案为:除去混合气体中的CO2;H2C2O4
| ||
(2)两者正好1:1反应生成NaHC2O4,溶液显酸性,说明HC2O4-的电离程度大于其水解程度,
故答案为:反应生成NaHC2O4,HC2O4-的电离程度大于其水解程度;
(3)两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度,而溶液中还存在着水的电离,故H+>C2O42-,由于离子的电离程度较小,则有HC2O4->H+,故正确顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
点评:本题考查已二酸的分解以及溶液离子浓度的大小比较,题目较为综合且具有一定难度,做题时注意抓住反应的现象,以此推断物质可能具有的性质.

练习册系列答案
相关题目
下列电离方程式中正确的是( )
| A、NH3?H2O═NH4++OH- |
| B、KClO3═K++Cl-+3O2- |
| C、CH3COOH═CH3COO-+H+ |
| D、NaOH═Na++OH- |
将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是( )
| A、一定没有乙烯 |
| B、一定有乙烯 |
| C、一定没有甲烷 |
| D、一定有甲烷 |