题目内容
氯气和二氧化硫是中学化学中常见的气体.
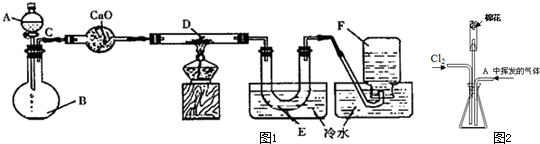
(1)某活动小组设计如图1所示装置图(图中夹持和加热装置略去),分别研究氯气和二氧化硫的性质.
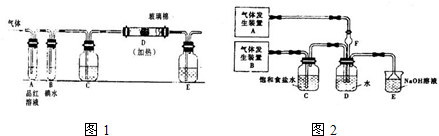
①从左端分别通入氯气或二氧化硫时,装置A中观察到相同的现象,其原理是否相同? (填“相同”或“不同”).
②装置E中盛放的物质可以为 ;若装置D装的是铁丝,通入氯气与铁丝充分反应时现象为 .
③当通入足量氯气完全反应后,向B中滴加淀粉溶液,无明显现象.若B中原有10.0mL 1.0mol?L-1的碘水,反应中共转移了0.1mol电子,则该反应的离子方程式为 (无需配平).
(2)为了探究同时通入氯气和二氧化硫时发生的反应,某兴趣小组同学地如图2所示的实验装置.则气体发生装置A中产生的气体是 ,F装置的作用是 .
(3)Na2SO3是抗氧剂,向烧碱和Na2SO3的混合溶液中加入少许溴水,振荡后溶液变为无色.碱性条件下Br2与Na2SO3溶液反应的离子方程式为 (不需配平).
(4)为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生反应化学方程式为 、 ,再喷射适量蒸馏水即得硫酸型酸雨,NO的作用为 .
(1)某活动小组设计如图1所示装置图(图中夹持和加热装置略去),分别研究氯气和二氧化硫的性质.

①从左端分别通入氯气或二氧化硫时,装置A中观察到相同的现象,其原理是否相同?
②装置E中盛放的物质可以为
③当通入足量氯气完全反应后,向B中滴加淀粉溶液,无明显现象.若B中原有10.0mL 1.0mol?L-1的碘水,反应中共转移了0.1mol电子,则该反应的离子方程式为
(2)为了探究同时通入氯气和二氧化硫时发生的反应,某兴趣小组同学地如图2所示的实验装置.则气体发生装置A中产生的气体是
(3)Na2SO3是抗氧剂,向烧碱和Na2SO3的混合溶液中加入少许溴水,振荡后溶液变为无色.碱性条件下Br2与Na2SO3溶液反应的离子方程式为
(4)为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生反应化学方程式为
考点:性质实验方案的设计
专题:实验设计题
分析:(1)①二氧化硫的漂白性是暂时的,而氯气与水反应生成HClO,次氯酸漂白为永久的;
②由装置可知,E的作用是吸收尾气,防止污染空气,可以用碱液吸收;氯气与铁反应产生棕红色的烟;
③通入足量的氯气,碘完全反应,根据转移电子数目计算I元素在氧化产物中的化合价,确定产物,据此书写;
(2)由装置图可知,C中饱和食盐水用于除去氯气中的氯化氢,则B装置用于制取氯气,所以A装置产生的气体为二氧化硫;球形漏斗可以避免倒吸现象;
(3)碱性溶液中Br2与Na2SO3发生氧化还原反应生成硫酸钠、溴化钠、水,据此书写离子方程式;
(4)根据物质的性质来书写方程式,根据一氧化氮在反应中的特点来判断所起到的作用.
②由装置可知,E的作用是吸收尾气,防止污染空气,可以用碱液吸收;氯气与铁反应产生棕红色的烟;
③通入足量的氯气,碘完全反应,根据转移电子数目计算I元素在氧化产物中的化合价,确定产物,据此书写;
(2)由装置图可知,C中饱和食盐水用于除去氯气中的氯化氢,则B装置用于制取氯气,所以A装置产生的气体为二氧化硫;球形漏斗可以避免倒吸现象;
(3)碱性溶液中Br2与Na2SO3发生氧化还原反应生成硫酸钠、溴化钠、水,据此书写离子方程式;
(4)根据物质的性质来书写方程式,根据一氧化氮在反应中的特点来判断所起到的作用.
解答:
解:(1)①二氧化硫具有漂白性,是二氧化硫与有色物质生成无色的化合物,该漂白为暂时的,加热后能够恢复,而氯气与水反应生成HClO,HClO具有强氧化性,能够氧化有色物质而漂白,该漂白为永久的,所以二者的漂白原理不同,
故答案为:不同;
②由装置可知,E的作用是吸收尾气,防止污染空气,可以用NaOH溶液吸收;氯气与铁反应产生棕红色的烟,
故答案为:NaOH溶液;产生棕红色的烟;
③装置B中装有10.0mL 1.0mol?L-1的碘水,当通入足量Cl2完全反应后,共转移了0.1mol电子,故I元素在氧化产物中的化合价为
=5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3,
故答案为:5Cl2+I2+6H2O=10HCl+2HIO3;
(2)C装置中的饱和食盐水用于除去氯气中的氯化氢,则B装置用于制取氯气,所以A装置产生的气体为二氧化硫;二氧化硫易溶于水,容易发生倒吸现象,而装置F中球形漏斗可以防止倒吸,
故答案为:二氧化硫;防止倒吸;
(3)碱性条件下,Br2与Na2SO3溶液反应生成硫酸钠和NaBr,该离子反应为SO32-+Br2+2OH-=H2O+SO42-+2Br-;该反应中溴从0价变为-1价,Br2为氧化剂,
故答案为:SO32-+Br2+2OH-=H2O+SO42-+2Br-;
(4)一氧化氮具有还原性,很容易被氧化,氧化后产物是二氧化氮,2NO+O2=2NO2,二氧化氮还可以将二氧化硫氧化,即NO2+SO2=SO3+NO,整个过程中,一氧化氮的质量没有发生变化,起到催化剂的作用,
故答案为:2NO+O2=2NO2;NO2+SO2=SO3+NO;催化剂.
故答案为:不同;
②由装置可知,E的作用是吸收尾气,防止污染空气,可以用NaOH溶液吸收;氯气与铁反应产生棕红色的烟,
故答案为:NaOH溶液;产生棕红色的烟;
③装置B中装有10.0mL 1.0mol?L-1的碘水,当通入足量Cl2完全反应后,共转移了0.1mol电子,故I元素在氧化产物中的化合价为
| 0.1mol |
| 0.01L×1mol/L×2 |
故答案为:5Cl2+I2+6H2O=10HCl+2HIO3;
(2)C装置中的饱和食盐水用于除去氯气中的氯化氢,则B装置用于制取氯气,所以A装置产生的气体为二氧化硫;二氧化硫易溶于水,容易发生倒吸现象,而装置F中球形漏斗可以防止倒吸,
故答案为:二氧化硫;防止倒吸;
(3)碱性条件下,Br2与Na2SO3溶液反应生成硫酸钠和NaBr,该离子反应为SO32-+Br2+2OH-=H2O+SO42-+2Br-;该反应中溴从0价变为-1价,Br2为氧化剂,
故答案为:SO32-+Br2+2OH-=H2O+SO42-+2Br-;
(4)一氧化氮具有还原性,很容易被氧化,氧化后产物是二氧化氮,2NO+O2=2NO2,二氧化氮还可以将二氧化硫氧化,即NO2+SO2=SO3+NO,整个过程中,一氧化氮的质量没有发生变化,起到催化剂的作用,
故答案为:2NO+O2=2NO2;NO2+SO2=SO3+NO;催化剂.
点评:本题考查性质实验方案的设计,涉及氯气与二氧化硫的制备、对装置的理解、对制备原理的评价、氯气与二氧化硫的性质等,题目难度中等,注意基础知识的理解掌握,试题充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
将112mLCl2(标准状况)通入10mL1mol/L的FeBr2溶液中(还原性:Fe2+大于Br-),发生反应的离子方程式是( )
| A、Cl2+2Br-═2Cl-+Br2 |
| B、2Fe2++Cl2═2Fe3++2Cl- |
| C、2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
| D、2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
下列物质属于塑料的是( )
| A、聚乙烯 | B、锦纶 |
| C、阿胶 | D、玻璃钢 |
 ),其过程如下:
),其过程如下:
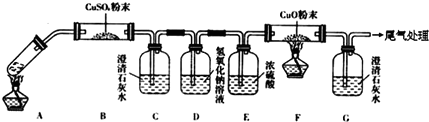
 工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:
工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:
