题目内容
固体硫化钠(Na2S)有强还原性,对于Na2S露置在空气中的变化,有如下假设:
假设①:固体Na2S易被空气中的氧气氧化为单质硫
假设②:固体Na2S易被空气中的氧气氧化为亚硫酸钠
假设③:固体Na2S易被空气中的氧气氧化为硫酸钠
为了探究固体Na2S露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎.
②将研钵中的样品露置在空气中两天.
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡.
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少.
回答下列问题:
(1)由实验现象分析,上述四种假设中,肯定不成立的是假设 .
(2)写出加入盐酸后产生气泡的离子方程式: .
(3)解释加塞振荡后产生浑浊,且气泡大量减少的原因 ,发生的化学方程式为 .
(4)如果要验证假设③是否成立的实验方法是: .
假设①:固体Na2S易被空气中的氧气氧化为单质硫
假设②:固体Na2S易被空气中的氧气氧化为亚硫酸钠
假设③:固体Na2S易被空气中的氧气氧化为硫酸钠
为了探究固体Na2S露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎.
②将研钵中的样品露置在空气中两天.
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡.
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少.
回答下列问题:
(1)由实验现象分析,上述四种假设中,肯定不成立的是假设
(2)写出加入盐酸后产生气泡的离子方程式:
(3)解释加塞振荡后产生浑浊,且气泡大量减少的原因
(4)如果要验证假设③是否成立的实验方法是:
考点:性质实验方案的设计
专题:实验设计题
分析:(1)单质硫不溶于水,也不溶于非氧化性酸;
(2)硫化钠和亚硫酸钠都和盐酸反应生成气体;
(3)硫化氢气体具有还原性,二氧化硫气体具有氧化性,二者混合发生氧化还原反应生成单质硫和水;
(4)假设3硫化钠被氧化成硫酸钠,故要检验硫酸根离子,依据检验硫酸根离子的实验方法设计.
(2)硫化钠和亚硫酸钠都和盐酸反应生成气体;
(3)硫化氢气体具有还原性,二氧化硫气体具有氧化性,二者混合发生氧化还原反应生成单质硫和水;
(4)假设3硫化钠被氧化成硫酸钠,故要检验硫酸根离子,依据检验硫酸根离子的实验方法设计.
解答:
解:(1)单质硫不溶于水,也不溶于非氧化性酸,故从加入盐酸全部溶解,证明没有单质硫生成,故假设1不成立;
故答案为:假设①;
(2)硫化钠和亚硫酸钠都和盐酸反应生成气体,反应的离子方程式为:S2-+2H+=H2S↑; SO32-+2H+=SO2↑+H2O;
故答案为:S2-+2H+=H2S↑、SO32-+2H+=SO2↑+H2O;
(3)硫化氢气体具有还原性,二氧化硫气体具有氧化性,二者混合发生氧化还原反应生成单质硫和水,故气泡数量减少,反应的离子方程式为:SO2+2H2S=3S↓+2H2O;
故答案为:SO2与H2S发生反应生成单质S;SO2+2H2S=3S↓+2H2O;
(4)假设3硫化钠被氧化成硫酸钠,故要检验硫酸根离子,应排除烟硫酸钠的干扰,故取少量样品加足量盐酸后充分振荡后过滤,再另取少量过滤后清液加入少量BaCl2溶液,若还有白色沉淀生成假设③成立在,若没有白色沉淀生成则假设③不成立;
故答案为:取少量样品加足量盐酸后充分振荡后过滤,再另取少量过滤后清液加入少量BaCl2溶液,若还有白色沉淀生成假设③成立在,若没有白色沉淀生成则假设③不成立.
故答案为:假设①;
(2)硫化钠和亚硫酸钠都和盐酸反应生成气体,反应的离子方程式为:S2-+2H+=H2S↑; SO32-+2H+=SO2↑+H2O;
故答案为:S2-+2H+=H2S↑、SO32-+2H+=SO2↑+H2O;
(3)硫化氢气体具有还原性,二氧化硫气体具有氧化性,二者混合发生氧化还原反应生成单质硫和水,故气泡数量减少,反应的离子方程式为:SO2+2H2S=3S↓+2H2O;
故答案为:SO2与H2S发生反应生成单质S;SO2+2H2S=3S↓+2H2O;
(4)假设3硫化钠被氧化成硫酸钠,故要检验硫酸根离子,应排除烟硫酸钠的干扰,故取少量样品加足量盐酸后充分振荡后过滤,再另取少量过滤后清液加入少量BaCl2溶液,若还有白色沉淀生成假设③成立在,若没有白色沉淀生成则假设③不成立;
故答案为:取少量样品加足量盐酸后充分振荡后过滤,再另取少量过滤后清液加入少量BaCl2溶液,若还有白色沉淀生成假设③成立在,若没有白色沉淀生成则假设③不成立.
点评:本题考查了性质实验方案的设计,中等难度,注意单质硫的溶解性和硫的不同价态的物质之间会发生氧化还原反应.

练习册系列答案
相关题目
下列现象或新技术的应用中,不涉及胶体性质的是( )
| A、在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 |
| B、使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 |
| C、清晨,在茂密的树林中,常常可以看到枝叶间透过的一道道光线 |
| D、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
新型纳米材料MFe2Ox(3<X<4)中,M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如下:MFe2Ox
MFe2Oy则下列判断正确的是( )
| 常温下 |
| SO2 |
| A、MFe2Ox是还原剂 |
| B、SO2是该反应的催化剂 |
| C、X>Y |
| D、氧化性:MFe2Ox>SO2 |
 ),其过程如下:
),其过程如下: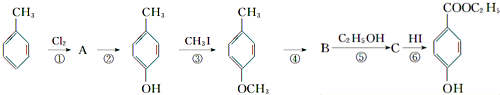
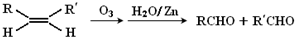

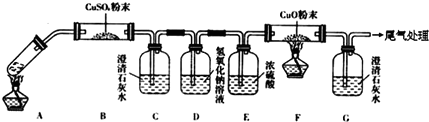
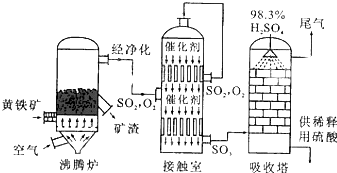 工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:
工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图: