题目内容
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、在常温常压下,2.24 L CO2中含有的原子数为0.3 NA |
| B、常温下,1 mol Cl2与足量的NaOH溶液反应,转移的电子数为NA |
| C、在同温同压下,3.2 g O2和0.4 g H2具有相同的体积 |
| D、1 mol Na2O2中含有的阴阳离子总数为4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、常温常压下,不能使用标况下的气体摩尔体积计算2.24L二氧化碳的物质的量;
B、常温下,氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,1mol氯气完全反应转移了1mol电子;
C、3.2g氧气的物质的量为0.1mol,0.4g氢气的物质的量为0.2mol,二者物质的量不同,具有的体积不相同;
D、过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中 含有2mol钠离子、1mol过氧根离子,总共含有3mol阴阳离子.
B、常温下,氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,1mol氯气完全反应转移了1mol电子;
C、3.2g氧气的物质的量为0.1mol,0.4g氢气的物质的量为0.2mol,二者物质的量不同,具有的体积不相同;
D、过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中 含有2mol钠离子、1mol过氧根离子,总共含有3mol阴阳离子.
解答:
解:A、不是标准状况下,题中条件无法计算2.24L二氧化碳的物质的量,所以无法计算2.24L二氧化碳中含有的原子数,故A错误;
B、常温下1mol氯气与足量的氢氧化钠溶液反应生成了氯化钠、次氯酸钠和水,转移了1mol电子,转移的电子数为NA,故B正确;
C、同温同压下,气体摩尔体积相同,3.2g氧气的物质的量为0.1mol,0.4g氢气的物质的量为0.2mol,所以二者含有的体积不相同,故C错误;
D、1mol过氧化钠中含有2mol阳离子钠离子和1mol过氧根离子,总共含有3mol阴阳离子,含有的阴阳离子总数为3NA,故D错误;
故选B.
B、常温下1mol氯气与足量的氢氧化钠溶液反应生成了氯化钠、次氯酸钠和水,转移了1mol电子,转移的电子数为NA,故B正确;
C、同温同压下,气体摩尔体积相同,3.2g氧气的物质的量为0.1mol,0.4g氢气的物质的量为0.2mol,所以二者含有的体积不相同,故C错误;
D、1mol过氧化钠中含有2mol阳离子钠离子和1mol过氧根离子,总共含有3mol阴阳离子,含有的阴阳离子总数为3NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
将足量CO2分别通入下列各溶液中,所含离子仍能大量共存的是( )
| A、K+、AlO2-、Cl-、NO3- |
| B、Na+、CH3COO-、C6H5O-、HCO3- |
| C、Na+、ClO-、SO42-、Cl- |
| D、NH4+、Al3+、SO42-、H+ |
关于下列四个说法正确的是( )
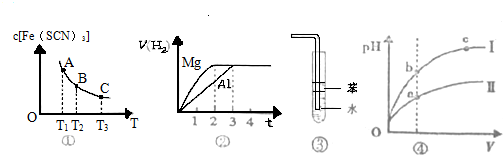

| A、已知图①是体系Fe3++3SCN-?Fe(SCB)3中c[Fe(SCN)3]与温度T的平衡图象,则A点与B点相比,A点的Fe3+浓度大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③可用于吸收HCl气体,并防倒吸 |
| D、图④是某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,II为醋酸稀释时pH的变化曲线 |
 已知A、B、D、E四种物质均含有氧元素.D为气体单质,E为黑色粉末.A和B分别经E催化都会分解产生D.B通常为液态,由两种元素组成,原子个数比为1:1,且1molB含18mol电子.试回答下列问题.
已知A、B、D、E四种物质均含有氧元素.D为气体单质,E为黑色粉末.A和B分别经E催化都会分解产生D.B通常为液态,由两种元素组成,原子个数比为1:1,且1molB含18mol电子.试回答下列问题.
 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示: